Основное уравнение молекулярно-кинетической теории идеального газа. Уравнение Менделеева-Клапейрона. Изопроцессы. Газовые законы.
1.Соотношение 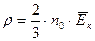 устанавливает связь между микроскопическими и макроскопическими величинами для газов. Поэтому это является основным уравнением МКТ.
устанавливает связь между микроскопическими и макроскопическими величинами для газов. Поэтому это является основным уравнением МКТ.
Макроскопические величины, которые однозначно характеризуют состояние газа, называют термодинамическими параметрами газа (V, p, T). Если V, p, T не изменяются, то газ находится в равновесии. Если хотя бы один из параметров изменяется, в газе происходит тот или иной процесс.
Когда процесс в газе завершается, то газ переходит в новое состояние, а его параметры принимают новые значения (численные). Если m = const, а значения V, p, T будут одинаковы в начале и в конце процесса, то такой процесс называют круговым или замкнутым.
Соотношение между значением параметров (V, p, T) в начале и в конце процесса называют газовым законом. Газовый закон, выражающий связь между всеми тремя параметрами называют объединенным газовым законом.
Связь между V, p, T и определенной m устанавливает соотношение: 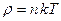
Так как 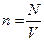 ;
; 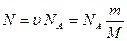 ;
; 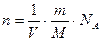
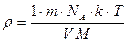 ;
; 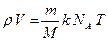 (1)
(1)
Произведение постоянной Больцмана на постоянную NА называют газовой постоянной – R
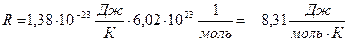 (2) Подставим (2) → (1) :
(2) Подставим (2) → (1) : 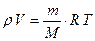 (3) - уравнение состояния газа
(3) - уравнение состояния газа
Уравнение состояния газа для какой-либо массы идеального газа. Это уравнение устанавливает связь между V, p, T идеального газа, который может находиться в двух каких-либо состояниях.
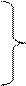 I состояние:
I состояние: 
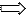
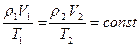
II состояние: 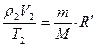

 (4)
(4) 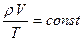 уравнение Клапейрона.
уравнение Клапейрона.
Уравнение (3) называют еще уравнением Клапейрона-Менделеева, так как оно впервые было получено Менделеевым.
2. Количественная зависимость между двумя параметрами газа при фиксированном значении третьего называют газовыми законами.
Процессы, протекающие при неизменном значении одного из параметров, называют изопроцессами.
Изотермический процесс /T=const/
Процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре называется изотермическим, («изос»-равный, «термос»-теплый).
Если T = const, то pV = const
Для газа данной массы, произведение давления газа на его объем постоянно, если температура газа не изменяется.


 Закон Р. Бойля – Е. Мариотта (англ.-франц.)
Закон Р. Бойля – Е. Мариотта (англ.-франц.)
Р
Изотерма (гипербола)
Пример: процесс сжатия
воздуха компрессором
О V
Изобарный процесс. / p = const /
Процесс изменения состояния термодинамической системы при постоянном давлении называется изобарным, («барос»-тяжелый)
Если p = const, то 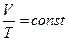 .
.
Для газа данной массы отношение объема к температуре остается неизменным, если давление газа не изменяется.


 Закон Ж. Гей – Люсака (франц.) 1802 г.
Закон Ж. Гей – Люсака (франц.) 1802 г.
 V р2 > р1
V р2 > р1
р1 Изобара
Изобарным процессом можно
р2 считать расширение газа при
нагревании его в цилиндре с

 подвижным поршнем.
подвижным поршнем.
0  Т
Т
---- так как объем не обращается в нуль, потому что все газы во время сильного сжатия и охлаждения превращаются в жидкость.
Изохорный процесс. V = const
Процесс изменения состояния термодинамической системы при постоянном объеме называется изохорным,(«хорема»-емкость).
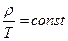 , если V = const
, если V = const
Для газа данной массы отношение давления к температуре постоянно, если объем не изменяется. Ж.Шарль (франц.) 1787 г.
 Р V1< V2
Р V1< V2
V1 Изохора
 Все изохоры начинаются в т О, то давление
Все изохоры начинаются в т О, то давление
ид. газа при абсолютном нуле равно нулю.
V2  Пример. Нагрев газа в электролампе.
Пример. Нагрев газа в электролампе.

 0 Т
0 Т
3. Силы взаимодействия между молекулами идеального газа отсутствуют. Поэтому внутренняя энергия идеального газа представляет собой только сумму значений кинетической энергии хаотичного движения всех его молекул.
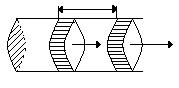
Опыт показывает, что сжатый газ в процессе своего расширения выполняет работу. Приборы, которые построены на этом свойстве газа называется пневматическим.
 |
 ∆ℓ P
∆ℓ P
F F


 S
S
|

 1 2 P
1 2 P
 0 V1 V2 V
0 V1 V2 V
 ∆V
∆V
A = p ∆V = p( V2 – V1) .
Газ выполняет работу только в процессе изменения своего объема, то есть ∆V≠ 0.
- Если газ расширяется (∆V > 0) работа положительна А´> 0.
- Если газ сжимается (∆V < 0), работа, которую выполняют внешние силы, отрицательна (А´< 0).
Дата добавления: 2015-10-19; просмотров: 1956;
