История развития учения о биологическом окислении.
1. Теория активации кислорода (А.Н.Бах). Согласно этой теории непосредственным агентом, окисляющим субстрат является активированный кислород. Активация молекулярного кислорода осуществляется особыми ферментами оксигеназами и ведет к образованию реакционноспособных пероксидов, которые при участии ферментов пероксидаз и взаимодействуют с субстратом.
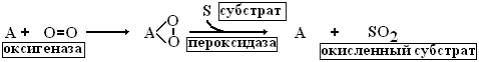
В дальнейшем оказалось, что действительно в клетках существует ферменты, способные активировать молекулярный кислород и использовать его для окисления ряда веществ. Существуют ферменты монооксигеназы, которые присоединяют к субстрату один атом кислорода (SH +1/2 O2 > SOH ) и диоксигеназы, которые присоединяют к субстрату 2 атома кислорода (S + O2 > SO2). Монооксигеназы и диоксигеназы катализируют реакции гидроксилирования стероидов, ксенобиотиков, образование простагландинов и лейкотриенов, но не принимают участия в процессах биологического окисления в митохондриях.
2.Теория активации водорода (Палладин, Украина). По этой теории, биологическое окисление может происходить путем дегидрирования субстрата и без участия кислорода, но при помощи коферментов – акцепторов водорода, т.е. окисление на первых этапах может происходить и в анаэробных условиях, а затем может идти при участии кислорода в аэробных условиях, в результате чего образуются молекулы воды.

Таким образом, Основным генератором энергии для процессов жизнедеятельности служат реакции биологического окисления, т.е. окислительно-восстановительные реакции, протекающие во всех живых системах. Реакции биологического окисления в клетках выполняют следующие функции: 1) запасание энергии, утилизируемой в форме трансмембранного электрохимического потенциала (ΔμН+) или макроэргических связей АТФ; 2) рассеивание энергии в форме тепла; 3) образование полезных соединений; 4) расщепление вредных веществ (рис. 5).
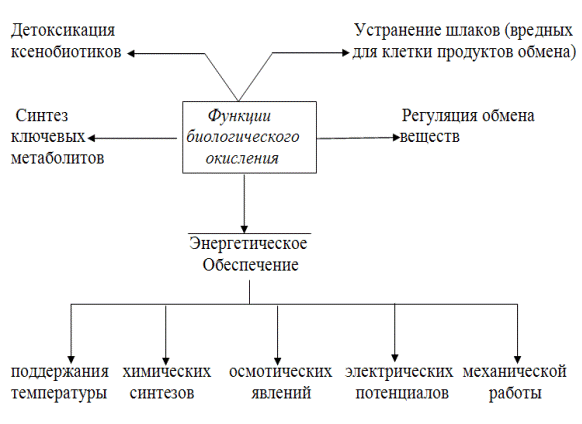
Рис. 5. Функции биологического окисления
Биологическое окисление, происходящее в животном организме, по сути, является процессом, обратным фотосинтезу. В ходе этих реакций высокоэнергетические электроны, находящиеся в молекулах углеводов и других соединений, переходят на уровень с наименьшей энергией, связываясь с кислородом в молекуле воды. Энергия, отдаваемая ими при этом, идет на образование макроэргических фосфатных связей, в основном АТФ (сопряженное окисление). Сопряженное окисление – ведущее звено во всех изученных к настоящему времени биологических генераторах энергии. Только через систему сопряженных реакций осуществляется передача энергии к преобразующим устройствам клетки, специализированным на выполнении определенного вида биологической работы.
Кроме окисления, сопряженного с синтезом универсальной энергетической валюты – АТФ, в организме человека имеет место и несопряженное или свободное окисление (дыхание), при котором не происходит синтеза АТФ, а энергия, высвобождаемая в процессах окисления используется для: 1) пластических целей (синтез биологически активных соединений, например стероидных гормонов, катехоламинов, эйкозаноидов и других соединений), 2) обезвреживания токсичных продуктов обмена веществ и лекарственных препаратов (микросомальное окисление, пероксидазы), 3) участия в воспалительных и иммунных реакциях, апоптозе (перекисное окисление липидов (ПОЛ), миелопероксидаза), 4) теплопродукции (разобщение окисления и фосфорилирования).
Функции сопряженного и свободного окисления представлены в таблице 2.
Таблица 2. Функции сопряженного и свободного окисления
| Функции | Тип дыхания | Механизм | Пример |
| Запасание энергии | Сопряженное | Генерация ΔμН+, исполь-зуемого для синтеза АТФ | Митохондриальная дыхательная цепь, окисляющая НАДН2 и ФАДН2 |
| Рассеивание энергии | Сопряженное | Генерация ΔμН+, исполь-зуемого для синтеза АТФ, гидролизуемого актомиозином | Мышечная дрожь при охлаждении |
| Рассеивание энер-гии | Свободное | Рассеивание образованного ΔμН+ благодаря действию разобщителей | Несократительный тер-могенез в скелетных мышцах и буром жире при охлаждении |
| Образование полезных веществ | Сопряженное | Генерация ΔμН+ и образование АТФ для биосинтезов | Большинство биосинте-зов (углеводов, липидов, белков, биологически активных соединений и др.) |
| Образование полезных веществ | Свободное | Перенос электронов по специализированным ды-хательным цепям | Цепи микросомального окисления в биосинтезе стероидных гормонов и др. |
| Удаление вредных веществ | Сопряженное | Генерация ΔμН+ и образование АТФ для процессов детоксикации | Включение аммиака в цикл синтеза мочевины |
| Удаление вредных веществ | Свободное | Перенос электронов по специализированным ды-хательным цепям | Дыхательная цепь эндо-плазматического ретикулума, окисляющая ксено-биотики |
| Образование и удаление вредных веществ | Свободное | Образование и нейтрали-зация активных форм ки-слорода | Перекисное окисление липидов и антиоксидантная система |
НАД – никотинамидадениндинуклеотид, НАДН2 – восстановленный кофермент
НАДФ – никотинамидадениндинуклеотид-фосфат
ФАД – флавинадениндинуклеотид
ФМН – флавинмононуклеотид
АДФ – аденозиндифосфат
НАДГ– никотинамидные дегидрогеназы
Свободное окисление Свободное окисление, не сопряженное с фосфорилированием АДФ, не сопровождается трансформацией энергии, выделяющейся при окислении в энергию макроэргических связей. При свободном окислении высвобождающаяся при сопряженном с окислением распаде химических связей энергия переходит в тепловую и рассеивается. По типу свободного окисления идут все без исключения оксигеназные реакции, все окислительные реакции, ускоряемые пероксидазами или сопровождающиеся образованием Н2О2, многие реакции, катализируемые оксидазами. Процессы свободного окисления сосредоточены в цитозоле, в мембране эндоплазматической сети клетки, в мембранах лизосом, пероксисом и аппарата Гольджи, на внешних мембранах митохондрий и хлоропластов. Они идут также в ядерном аппарате клетки. Свободное окисление выполняет важные биологические функции, оно обеспечивает поддержание температуры тела на более высоком энергетическом уровне, чем температура окружающей среды. Биологическое окисление выполняет важную функцию модификации чужеродных соединений (ксенобиотиков).
Окисление, сопряженное с фосфорилированием АДФ. Такой тип биологического окисления может осуществляться несколькими способами: – на уровне субстрата (субстратное фосфорилирование); сосредоточено в растворимой части клеток; – на уровне электронно-транспортной цепи (окислительное фосфорилирование); сопряжение идет на внутренних мембранах митохондрий. Механизм фотосинтетического и хемосинтетического фосфорилирования АДФ, сопровождающегося биосинтезом АТФ, близок к таковому при окислительном фосфорилировании в митохондриях. Примерами сопряжения окисления с фосфорилированием на уровне субстрата могут служить реакции окисления 3-фосфоглицеринового альдегида в 1,3-дифосфоглицериновую кислоту, 2-фосфоглицериновой кислоты – в 2-фосфоенолпировиноградную, a-кетоглутаровой кислоты – в янтарную. Однако посредством реакций субстратного фосфорилирования образуется сравнительно небольшое количество АТФ. Главная масса АТФ у аэробных организмов синтезируется путем окислительного фосфорилирования в митохондриях.
Дыхательня цепь – это система ферментов и коферментов, которые принимают участие в транспорте электронов и протонов от окисляемого субстрата к кислороду. Дыхательная цепь включает: а) ферменты: НАД- или ФМН(ФАД)-зависимые дегидрогеназы; цитохромы (гемопротеины,
(комплексы), связанные между собой убихиноном (КоQ) и цитохромом с. Процесс начинается с переноса протонов и электронов от окисляемого субстрата на коферменты НАД или ФАД. Последнеее определяется тем, является ли дегидрогеназа, катализирующая первую стадию, НАД-зависимой или ФАД-зависимой. Но каким содержащие простетическую группу гем); б) коферменты: НАД, ФМН, КоQ, гем. в) електронотранспортные белки (железосерные белки).
Все участники этой цепи разделены на четыре окислительно-восстановительные системы бы ни был исходный субстрат, электроны и протоны от флавинов переносятся к коферменту Q, после которого пути электронов и протонов расходятся: электроны далее транспортируются по цепи цитохромов, а протоны переносятся из матрикса в межмембранное пространство.
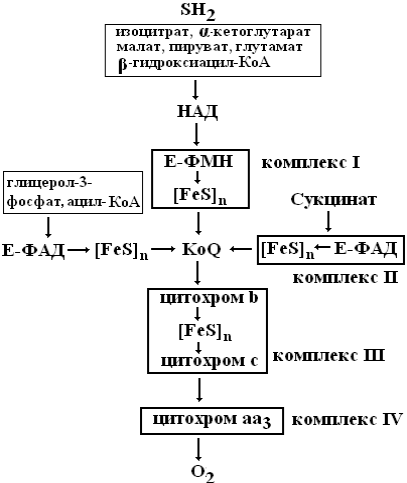
Состав комплексов дыхательной цепи:
I комплекс – НАД.Н–коэнзим Q–оксидоредуктаза. Включает ключевой фермент НАДН-дегидрогеназа и 5 железо-серных кластеров (железосерные белки). Благодаря НАДН-дегидрогеназе (кофермент ФМН) и железосерным белкам комплекс I катализирует перенос атомов водорода и электронов к коэнзиму Q.
II комплекс (сукцинатдегидрогеназный (СДГ). Включает ФАД-зависимую сукцинатдегидрогеназу, железосерные белки и катализирует перенос электронов от сукци-
ната на коэнзим Q. Коэнзим Q является коллектором электронов и атомов водорода не только от I и II комплексов, но также и от ФАД-зависимых ферментов бета-окисления жирных кислот и других дегидрогеназ.
III комплекс – КоQ.Н2-цитохром-С-оксидоредуктаза. Включает цитохромы b и c и один железосерный белок. Комплекс осуществляет перенос электронов от восстановленной формы коэнзима Q к цитохрому с.
 QН2 + цитохром с (Fe3+) Q + цитохром с (Fe2+) + 2H+
QН2 + цитохром с (Fe3+) Q + цитохром с (Fe2+) + 2H+
IV комплекс – (цитохромоксидаза). Включает 2 цитохрома (а и а3), (которые обозначаются как цитохромоксидаза), которые содержат 2 атома меди (медь также способна переносит электроны Cu1+ Cu2+). Цитохромоксидаза катализирует конечную реакцию биологического окисления – восстановление 2 электронами кислорода и образование воды.

 2е- + 1/2О2 О2-; 2Н+ О2- Н2О
2е- + 1/2О2 О2-; 2Н+ О2- Н2О
Таким образом, комплексы I, III и IV обеспечивают постепенный перенос электронов и протонов от субстрата к кислороду. Энергия, которая высвобождается при движении электронов используется для переноса протонов из матрикса митохондрий в межмембранное пространство, где создается градиент концентраций ионов Н+, а этот градиент используется АТФ-синтазой для образования АТФ. Поэтому иногда выделяют еще комплекс V, который представлен Н+-транспортирующей АТФ-синтаза, хотя она и не переносит электроны.
Поглощенный клеткой кислород в основном (до 80-90%) используется для производства энергии в митохондриях. Однако, кислород используется и на другие цели – для синтеза стероидов, простагландинов, лейкотриенов, тирозина, катехоламинов, для метаболизма чужеродных веществ и т.д.. При этом часть поглощенного тканями кислорода не ферментативным путем или при участии монооксигеназ способна превращаться в активные формы (супероксидный, гидроксильный. пероксильный радикалы, синглетный кислород, пероксид водорода, органическое пероксиды)
Например, в митохондриях около 8% кислорода может превращаться в активные формы, поскольку ФМНН2 способен отдавать электороны не только на убихинон, но и непосредственно на молекулу кислорода, превращая его в супероксидный радикал. Супероксидный радикал и пероксид водорода, образуется также и под влиянием ксантиноксидазы, монооаминоксидазы, НАДФН-оксидазы, цитохрома Р450 и т.д. Супероксидный радикал при участии фермента супероксиддисмутазы превращается в пероксид водорода (Н2О2), а последний разрушается до воды каталазой и пероксидазой, глутатионпероксидазой). Ферменты обезвреживающие активные формы кислорода называются антиоксидантными, поскольку они защищают клетку от окислительного повреждения.
В клетках существуют специальные системы обезвреживания токсичных кислородных радикалов, в частности ферментные: супероксиддисмутаза, катализирующая превращение супероксида в перекись водорода, каталаза и пероксидазы, катализирующие реакции, в которых перекись водорода восстанавливается до воды. К наиболее реакционноспособным и поэтому наиболее опасным радикалам кислорода относится гидроксильный радикал •ОН — один из основных повреждающих факторов при действии на живой организм.
Ферменты обезвреживающие активные формы кислорода называются антиоксидантными, поскольку они защищают клетку от окислительного повреждения.
НАДФН + 2O2 > НАДФ+ + 2О2- + Н+ (О2- – супероксидный радикал)
O2- + O2- + 2Н+ > Н2О2 +О2 (супероксиддисмутаза) _
2H2O2 > 2H2O + O2 (каталаза)
H2O2 > H2O + O (пероксидаза)
H2O2 + 2G-SH > H2O + G-S-S-G (глутатионпероксидаза)
Ферменты, катализирующие окислительно-восстановительные реакции,
называют оксидоредуктазами. Согласно международной классификации и номенклатуре ферментов оксидоредуктазы относятся к 1 классу, в пределах которого выделяют двадцать два подкласса:
Их разделяют на 5 групп.
1. Оксидазы. Они катализируют удаление водорода из субстрата, используя при этом в качестве акцептора водорода только кислород.
Оксидазы содержат медь, продуктом реакции является вода. Широко распространена в растительных животных тканях цитохромоксидаза (цитохром аа3). Она служит конечным компонентом цепи дыхательных переносчиков, локализованных в митохондриях, и катализирует реакцию, в результате которой электроны, высвобождающиеся из молекул субстрата при их окислении дегидрогеназами, переносятся на кислород.
Фенолаза катализирует превращение монофенола в о-фенол; уриказа катализирует окисление мочевой кислоты в аллантоин; моноаминоксидаза окисляет адреналин и тиамин в митохондриях.
2. Аэробные дегидрогеназы – ферменты, катализирующие удаление водорода из субстрата они переносят водород непосредственно на молекулярный кислород и в отличие от оксидаз они могут использовать в качестве акцептора водорода не только кислород, но и искусственные акцепторы, такие как метиленовый синий.
Эти дегидрогеназы относятся к флавопротеинам, и продуктом катализируемой ими реакции является перекись водорода, а не вода. Аэробные дегидрогеназы содержат в качестве простетической группы флавинмононкулеотид (ФМН) или флавнадениндинуклеотид (ФАД). (ФМН) и (ФАД) образуются в организме из рибофлавина (витамин В2). Многие флавопротеиновые ферменты содержат один или несколько ионов металлов, выполняющих роль кофакторов; такие флавопротеиновые ферменты называют флавопротеинами.
К ферментам группы аэробных дегидрогеназ относятся также дегидрогеназа L-аминокислот(ФМН-содержащий фермент), катализирующая окислительное дезаминирование природных L-аминокислот. Широко распространена ксантиндегидрогеназа (ксантиноксидаза), она обнаружена в молоке, тонком кишечнике, почках и печени. Ксантиндегидрогеназа содержит молибден; играет важную роль в превращении пуриновых оснований в мочевую кислоту и особое значение имеет в печени и в почках птиц, которые экскретируют мочевую кислоту как главный конечный азотофиксирующий продукт метаболизма пуринов, а также катаболизма белков и аминокислот.
Альдегиддегидрогеназа – FAD-содержащий фермент, находящийся в печени млекопитающих. Это – металлофлавопротеин, содержащий молибден и негемовое железо, окисляющий альдегиды и N-гетероциклические субстраты.
Глюкозооксидаза – FAD-специфичный фермент, получаемый из грибов; используется при определении глюкозы.
3. Анаэробные дегидрогеназы – ферменты, катализирующие удаление водорода из субстрата, но не способные использовать кислород в качестве акцептора водорода.
Эти ферменты выполняют две главные функции:
а) Перенос водорода с одного субстрата на другой в сопряженной окислительно-восстановительной реакции. Эти дегидрогеназы специфичны к субстратам, но часто используют один и тот же кофермент или переносчик водорода.
б) Функцию компонентов дыхательной цепи, обеспечивающих транспорт электоронов от субстрата на кислород.
Среди анаэробных дегидрогеназ различают дегидрогеназы, зависимые от никотинамидных коферментов, рибофлавиновые дегидрогеназы, цитохромы. NAD-зависимые дегидрогеназы катализируют окислительно-восстановительные реакции окислительных путей метаболизма – гликолиза, цикла лимонной кислоты, дыхательной цепи митохондрий. NADP-зависимые дегидрогеназы участвуют в процессах восстановительного синтеза, в частности, во внемитохондриальном синтезе жирных кислот и стероидов; они также являются коферментами дегидрогеназ пентозофосфатного пути.
Большинство раибофлавин-зависимых аэробных дегидрогеназ либо участвуют в транспорте электронов по дыхательной цепи, либо поставляют электроны для этой цепи. NADН-дегидрогеназа – компонент дыхательной цепи, переносящий электроны от NADH к более электроположительным компонентам. Другие дегидрогеназы, например, сукцинатдегидрогеназа, ацил-СоА-дегидрогеназа и митохондриальная глицерол-3-фосфат-дегидрогеназа, переносят восстановительные эквиваленты от субстрата непосредственно на дыхательную цепь.
Цитохромы служат переносчиками электронов от флавопротеинов к цитохромоксидазе. Помимо дыхательной цепи цитохромы имеются в эндоплазматическом ретикулуме (цитохромы Р-450 и b5 ), в растительных клетках, бактериях и дрожжах.
4. Гидроксипероксидазы – ферменты, использующие в качестве субстрата перекись водорода или органические перекиси. К этой категории относятся два типа ферментов: пероксидазы, находящиеся в составе молока, в растениях, лейкоцитах, тромбоцитах, эритроцитах и т. д., и каталаза, функционирующая в тканях животных и растений.
5. Оксигеназы – катализирующие прямое введение кислорода в молекулу субстрата. Оксигеназы не относятся к ферментам, катализирующим реакции, снабжающие клетку энергией; они участвуют в синтезе и деградации многих типов метаболитов. Ферменты этой группы делятся на две подгруппы:
а) Диоксигеназы (кислород-трансферазы, истинные оксигеназы). Эти ферменты катализируют включение в молекулу субстрата обоих атомов молекулы кислорода:
А + О2 ® АО2
Примером служат железосерные ферменты гомогентизатдиоксигеназа и 3-гидроксиантранилат-диоксигеназа, а также гемсодержащие ферменты, в частности L-триптофандиоксигеназа (триптофанпирролаза).
б) Монооксигеназы (оксидаза со смешанной функцией, гидроксилазы). Эти ферменты катализируют включение в субстрат только одного из атомов молекулы кислорода. Другой атом кислорода восстанавливается до воды; для этой цели необходим дополнительный донор электронов (косубстрат):
А – Н + О2 + ZН2 ® А – ОН + Н2О + Z
3.3. Аденозинтрифосфорная кислота (АТФ), особенности ее химического строения, биологическая роль.
Аденозинтрифосфа́т (сокр. АТФ, англ. АТР) C10H16N5O13P3 – нуклеотид, играет исключительно важную роль в обмене энергии и веществ в организмах; в первую очередь соединение известно как универсальный источник энергии для всех биохимических процессов, протекающих в живых системах. АТФ был открыт в 1929 году Карлом Ломанном, а в 1941 году Фриц Липман показал, что АТФ является основным переносчиком энергии в клетке.
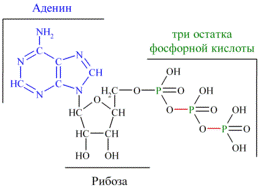
Структура аденозинтрифосфорной кислоты
АТФ относится к так называемым макроэргическим соединениям, то есть к химическим соединениям, содержащим связи, при гидролизе которых происходит освобождение значительного количества энергии. Гидролиз макроэргических связей молекулы АТФ, сопровождаемый отщеплением 1 или 2 остатков фосфорной кислоты, приводит к выделению, по различным данным, от 40 до 60 кДж/моль.
АТФ + H2O → АДФ + H3PO4 + энергия
АТФ + H2O → АМФ + H4P2O7 + энергия
Высвобожденная энергия используется в разнообразных процессах, протекающих с затратой энергии.
Роль в организме. Главная роль АТФ в организме связана с обеспечением энергией многочисленных биохимических реакций. Являясь носителем двух высокоэнергетических связей, АТФ служит непосредственным источником энергии для множества энергозатратных биохимических и физиологических процессов. Всё это реакции синтеза сложных веществ в организме: осуществление активного переноса молекул через биологические мембраны, в том числе и для создания трансмембранного электрического потенциала; осуществления мышечного сокращения.
Помимо энергетической АТФ выполняет в организме ещё ряд других не менее важных функций:
· Вместе с другими нуклеозидтрифосфатами АТФ является исходным продуктом при синтезе нуклеиновых кислот.
· Кроме того, АТФ отводится важное место в регуляции множества биохимических процессов. Являясь аллостерическим эффектором ряда ферментов, АТФ, присоединяясь к их регуляторным центрам, усиливает или подавляет их активность.
· АТФ является также непосредственным предшественником синтеза циклического аденозинмонофосфата — вторичного посредника передачи в клетку гормонального сигнала.
· Также известна роль АТФ в качестве медиатора в синапсах.
Пути синтеза.В организме АТФ синтезируется путём фосфорилирования АДФ:
АДФ + H3PO4 + энергия → АТФ + H2O.
Фосфорилирование АДФ возможно двумя способами: субстратное фосфорилирование и окислительное фосфорилирование (используя энергию окисляющихся веществ). Основная масса АТФ образуется на мембранах митохондрий в ходе окислительного фосфорилирования H-зависимой АТФ-синтазой. Субстратное фосфорилирование АТФ не требует участия мембранных ферментов, оно происходит в процессе гликолиза или путём переноса фосфатной группы с других макроэргических соединений.
Субстратное фосфорилирование является ведущим при гипоксии, протекает как в матриксе митохондрий, так и в цитоплазме клеток. При этом энергия окисления субстрата, накапливаемая в виде макроэргической связи, переносится на адениловую кислоту, образуя АТФ в реакциях перефосфорилирования (деацилирования), катализируемых специфическими киназами (фосфоглицераткиназа, пируваткиназа, сукцинил-SКоА-тиокиназа и др.).
В отличие от окислительного фосфорилирования, сопряженного с переносом электронов, при субстратном фосфорилировании донором активированной фосфорильной группы (~РО3Н2), необходимой для регенерации АТФ, являются промежуточные метаболиты гликолиза (1,3-бисфосфоглицерат, фосфоенолпиру-ват) и цикла трикарбоновых кислот (сукцинил-КоА). Во всех этих случаях окислительные процессы приводят к образованию высокоэнергетических соединений, которые при участии соответствующих ферментов способны фосфорилировать АДФ с образованием АТФ.
фосфоглицераткиназа
1,3-Бисфосфоглицерат + АДФ 3-Фосфоглицерат + АТФ
пируваткиназа
Фосфоенолпируват + АДФ Пируват + АТФ
сукцинил-КоА-тиокиназа
Сукцинил-КоА + ГДФ + Фн Сукцинат + ГТФ + HSKoA
Важным обстоятельством является то, что трансформация энергии на уровне субстрата является единственным путем синтеза АТФ в анаэробных организмах. В организме человека этот процесс синтеза АТФ позволяет поддерживать
Окислительное фосфорилирование– это процесс синтеза АТФ из АДФ и неорганического фосфата, сопряженный с транспортом электронов по дыхательной цепи к кислороду. Этот процесс может быть разделен на три части:
1. биохимические реакции, генерирующие электроны с высоким уровнем энергии (НАДН2 или ФАДН2), так называемое первичное окисление;
2. мембранная система транспорта электронов, которая позволяет превращать энергию высокоэнергетических электронов в энергию электрохимического протонного градиента (терминальное окисление);
3. АТФ-синтетаза (Н+-зависимая аденозинтрифосфатаза), которая использует протонный градиент для производства АТФ.
Следует заметить, что окислительное фосфорилирование служит основным источником энергии в клетках. Следовательно, дефекты на любом этапе этого пути могут приводить к нарушению функции клеток, и в первую очередь, работы мышц и головного мозга.
Реакции фосфорилирования АДФ и последующего использования АТФ в качестве источника энергии образуют циклический процесс, составляющий суть энергетического обмена.
В процессе мышечной деятельности происходит непрерывный ресинтез АТФ. В зависимости от интенсивности и продолжительности работы он либо обеспечивает поддержание баланса АТФ, либо восполняет часть расходуемой АТФ. Ресинтез АТФ обеспечивается двумя процессами энергообеспечения - анаэробным, для которого не нужен кислород, и аэробным(дыхательным), требующим обязательного его наличия.
К первому принадлежат креатинфосфокиназная и миокиназная реакция, гликолитическое фосфорилирование и восстановительное образование сукцината (фермента). Ко вторым – субстратное и медиаторное дыхательное фосфорилирование. Анаэробные и аэробные возможности полностью характеризуют функциональный «потолок» организма – его общий энергетический потенциал, находящийся в тесной зависимости от генетических факторов
В организме АТФ является одним из самых часто обновляемых веществ, так у человека продолжительность жизни одной молекулы АТФ менее 1 мин. В течение суток одна молекула АТФ проходит в среднем 2000—3000 циклов ресинтеза (человеческий организм синтезирует около 40 кг АТФ в день), то есть запаса АТФ в организме практически не создаётся, и для нормальной жизнедеятельности необходимо постоянно синтезировать новые молекулы АТФ.
Вопросы для повторения
Дата добавления: 2015-10-19; просмотров: 2337;
