Закон действия масс
При постоянной температуре скорость химической реакции прямо пропорциональна концентрации реагирующих веществ в степени, равной коэффициенту перед формулой данного вещества в уравнении реакции.
Пример:для реакции, записанной в общем виде тА + пВ = qАВ скорость реакции может быть выражена уравнением
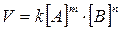
т и п - коэффициенты реагирующих веществ.
Пример:
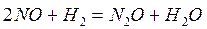
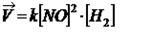
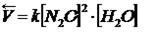
Коэффициент пропорциональности «k» называется константой скорости реакции, зависящая от природы реагирующих веществ, температуры и от присутствия катализатора, но не зависящая от концентрации - в этом существенная разница между константой и скоростью реакции. При концентрации каждого из реагирующих веществ, равных
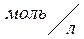 1 , k равна скорости химической реакции.
1 , k равна скорости химической реакции.
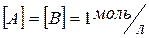 ;
; 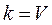
Закон действия масс справедлив только для наиболее простых по своему механизму взаимодействия. Сложные реакции могут быть совокупностью параллельно или последовательно протекающих процессов.
Закон действия масс справедлив для каждой отдельной стадии реакции, но не для всего взаимодействия в целом. Та стадия процесса, скорость которой минимальна, лимитирует скорость реакции в общем.
Дата добавления: 2015-09-07; просмотров: 799;
