Закон Гесса.
В 1841 году российский ученый Г. И. Гесс открыл закон.
 Изменение энтальпии(или тепловой эффект процесса) зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути перехода.
Изменение энтальпии(или тепловой эффект процесса) зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути перехода.
Рассмотрим это на примере реакции горения углерода:
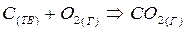
| 
| |
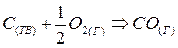
| 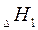
| |
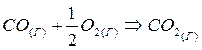
| 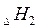
| 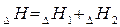
|
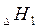
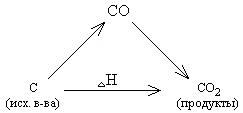
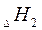
Это означает, что тепловой эффект окисления графита в 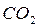 будет одинаковым произойдет ли окисление непосредственно или через промежуточное образование. Алгебраическая сумма тепловых эффектов двух стадий
будет одинаковым произойдет ли окисление непосредственно или через промежуточное образование. Алгебраическая сумма тепловых эффектов двух стадий 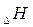 равна тепловому эффекту прямого окисления.
равна тепловому эффекту прямого окисления.
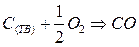 +
+
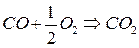
| 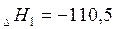 кДж/моль кДж/моль
|
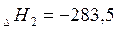 кДж/моль кДж/моль
| |
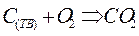
|
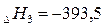 кДж/моль кДж/моль
|

1. Тепловой эффект прямой реакции равен по величине и противоположен по знаку обратной реакции.
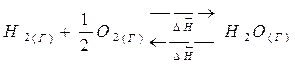
|
( 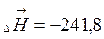 кДж/моль кДж/моль
|
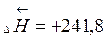 кДж/моль) кДж/моль)
|
2. Суммарный тепловой эффект обратимого процесса равен нулю;
3. Тепловой эффект реакции равен разности сумм стандартных энтальпий образования продуктов реакции и сумм стандартных энтальпий образования исходных веществ.
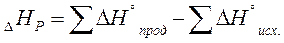 |
Дата добавления: 2015-09-07; просмотров: 820;
