Салициловая кислота Ацетилсалициловая кислота Бензойная кислота
Кдис = 1,06∙10-3 Кдис. = 6,3·10-5
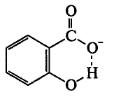
Наличие сильной внутримолекулярной водородной связи между
-СООН и -ОН обусловливает более активные кислотные свойства и стабильность, образование мононатриевых солей только по карбоксильной группе кислоты салициловой.
За счёт кислотных свойств
1.1 кислоты образуются растворимые соли с гидроксидами, карбонатами и гидрокарбонатами (отличие от фенолов) щелочных металлов.
Натриевые соли в отличие от самих кислот легко растворимы в воде.
1.2 За счёт карбоксильной группы с ионами Сu2+, Со2+, Fe3+, Ag+ образуют окрашенные, трудно растворимые соли.
1.3 Минеральные кислоты как более сильные вытесняют ароматические кислоты из их солей
2. Ароматические кислоты образуют производные:
2.1. Сложные эфиры – со спиртами (с метанолом – метилсалицилат с резким запахом) и фенолами. Салициловая кислота может образовывать эфиры и по фенольному гидроксилу.
2.2. Амиды– с аминами, ангидриды – с уксусным ангидридом, галогенангидриды – с хлорангидридом (подобно карбоновым кислотам).
3. Реакции электрофильного замещения имеют значение только для фенолокислот:
Группа – СООН является электроакцепторным заместителем, т.е. стягивает электронную плотность с ядра и дезактивирует его.
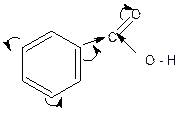
Поэтому реакция электрофильного замещения замедляется и затрудняется; в анализе бензойной кислоты не используется. Если имеются ориентанты 1 рода (-OH-, -NН2), то реакции электрофильного замещения проходят в мягких условиях и количественно (аминобензойная и гидроксибензойная кислоты).
3.1 галогенирование
3.2 конденсации (салициловая кислота)
Дата добавления: 2015-09-07; просмотров: 1701;
