Кислота – это сложное вещество, в молекуле которого имеется один или несколько атомов водорода и кислотный остаток.
Свойства кислот определяются тем, что они способны замещать в своих молекулах атомы водорода на атомы металлов. Например:
| H2SO4 | + | Mg | = | MgSO4 | + | H2 |
| серная кислота | металл | соль | водород | |||
| H2SO4 | + | MgO | = | MgSO4 | + | H2O |
| серная кислота | оксид | соль | вода |
На примере серной кислоты рассмотрим ее образование из кислотного оксида SO3, а затем реакцию серной кислоты с магнием. Валентности всех элементов, участвующих в реакции, нам известны, поэтому напишем соединения в виде структурных формул:
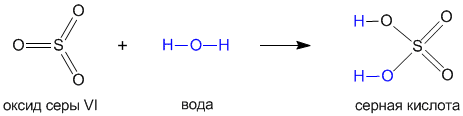
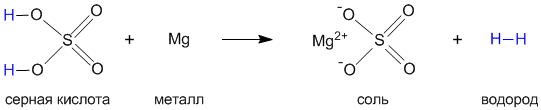
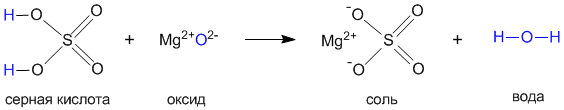
Эти примеры позволяют легко проследить связь между кислотным оксидом SO3, кислотой H2SO4 и солью MgSO4. Одно «рождается» из другого, причем атом серы и атомы кислорода переходят из соединения одного класса (кислотный оксид) в соединения других классов (кислота, соль).
Кислоты классифицируют по таким признакам: а) по наличию или отсутствию кислорода в молекуле б) по числу атомов водорода. По первому признаку кислоты делятся на кислородсодержащие и бескислородные
Таблица 4.1. Классификация кислот по составу.
| Кислородсодержащие кислоты | Бескислородные кислоты |
| H2SO4 серная кислота H2SO3 сернистая кислота HNO3 азотная кислота H3PO4 фосфорная кислота H2CO3 угольная кислота H2SiO3 кремниевая кислота | HF фтороводородная кислота HCl хлороводородная кислота (соляная кислота) HBr бромоводородная кислота HI иодоводородная кислота H2S сероводородная кислота |
По количеству атомов водорода, способных замещаться на металл, все кислоты делятся на одноосновные (с одним атомом водорода), двухосновные (с 2 атомами водорода) и трехосновные (с 3 атомами водорода), как показано в табл. 4.2:
Таблица 4.2. Классификация кислот по числу атомов водорода.
| К И С Л О Т Ы | ||
| Одноосновные | Двухосновные | Трехосновные |
| HNO3 азотная HF фтороводородная HCl хлороводородная HBr бромоводородная HI иодоводородная | H2SO4 серная H2SO3 сернистая H2S сероводородная H2CO3 угольная H2SiO3 кремниевая | H3PO4 фосфорная |
Термин «одноосновная кислота» возник потому, что для нейтрализации одной молекулы такой кислоты требуется одно основание, т.е. одна молекула какого-либо простейшего основания типа NaOH или KOH:
HNO3 + NaOH = NaNO3 + H2O
HCl + KOH = KCl + H2O
Двухосновная кислота требует для своей нейтрализации уже два основания, а трехосновная – три основания:
H2SO4 + 2 NaOH = Na2SO4 + 2 H2O
H3PO4 + 3 NaOH = Na3PO4 + 3 H2O
Рассмотрим важнейшие химические свойства кислот.
1. Действие растворов кислот на индикаторы. Практически все кислоты (кроме кремниевой) хорошо растворимы в воде. Растворы кислот в воде изменяют окраску специальных веществ – индикаторов. По окраске индикаторов определяют присутствие кислоты. Индикатор лакмус окрашивается растворами кислот в красный цвет, индикатор метиловый оранжевый – тоже в красный цвет.
Индикаторы представляют собой вещества сложного строения. В растворах оснований и в нейтральных растворах они имеют иную окраску, чем в растворах кислот.
2. Взаимодействие кислот с основаниями. Эта реакция, называется реакцией нейтрализации. Кислота реагируют с основанием с образованием соли, в которой всегда в неизменном виде обнаруживается кислотный остаток. Вторым продуктом реакции нейтрализации обязательно является вода. Например:
| кислота | основание | соль | вода | |||
| H2SO4 | + | Ca(OH)2 | = | CaSO4 | + | 2 H2O |
| H3PO4 | + | Fe(OH)3 | = | FePO4 | + | 3 H2O |
| 2 H3PO4 | + | 3 Ca(OH)2 | = | Ca3(PO4)2 | + | 6 H2O |
Для реакций нейтрализации достаточно, чтобы хотя бы одно из реагирующих веществ было растворимо в воде. Поскольку практически все кислоты растворимы в воде, они вступают в реакции нейтрализации не только с растворимыми, но и с нерастворимыми основаниями. Исключением является кремниевая кислота, которая плохо растворима в воде и поэтому может реагировать только с растворимыми основаниями – такими как NaOH и KOH:
H2SiO3 + 2 NaOH = Na2SiO3 + 2H2O
3. Взаимодействие кислот с основными оксидами. Поскольку основные оксиды – ближайшие родственники оснований – с ними кислоты также вступают в реакции нейтрализации:
| кислота | оксид | = | соль | + | вода | |
| 2 HCl | + | CaO | = | CaCl2 | + | H2O |
| 2 H3PO4 | + | Fe2O3 | = | 2 FePO4 | + | 3 H2O |
Как и в случае реакций с основаниями, с основными оксидами кислоты образуют соль и воду. Соль содержит кислотный остаток той кислоты, которая использовалась в реакции нейтрализации.
Например, фосфорную кислоту используют для очистки железа от ржавчины (оксидов железа). Фосфорная кислота, убирая с поверхности металла его оксид, с самим железом реагирует очень медленно. Оксид железа превращается в растворимую соль FePO4, которую смывают водой вместе с остатками кислоты.
4. Взаимодействие кислот с металлами. Для взаимодействия кислот с металлом должны выполняться некоторые условия (в отличие от реакций кислот с основаниями и основными оксидами, которые идут практически всегда).
Во-первых, металл должен быть достаточно активным (реакционноспособным) по отношению к кислотам. Например, золото, серебро, ртуть и некоторые другие металлы с кислотами не реагируют. Такие металлы как натрий, кальций, цинк – реагируют очень активно с выделением газообразного водорода и большого количества тепла.
| Кислота | + | металл | = | соль | + | H2 |
| HCl | + | Hg | = | не образуется | ||
| 2 HCl | + | 2 Na | = | 2 NaCl | + | H2 |
| H2SO4 | + | Zn | = | ZnSO4 | + | H2 |
По реакционной способности в отношении кислот все металлы располагаются в ряд активности металлов (табл. 4-3). Слева находятся наиболее активные металлы, справа – неактивные. Чем левее находится металл в ряду активности, тем интенсивнее он взаимодействует с кислотами.
Таблица 4.3. Ряд активности металлов.
| Металлы, которые вытесняют водород из кислот | Металлы, которые не вытесняют водород из кислот |
| K Ba Ca Na Mg Al Mn Zn Cr Fe Ni Sn Pb (H) самые активные металлы | Cu Hg Ag Pt Au самые неактивные металлы |
Во-вторых, кислота должна быть достаточно сильной, чтобы реагировать даже с металлом из левой части табл. 4-3. Под силой кислоты понимают ее способность отдавать ионы водорода H+.
Например, кислоты растений (яблочная, лимонная, щавелевая и т.д.) являются слабыми кислотами и очень медленно реагируют с такими металлами как цинк, хром, железо, никель, олово, свинец (хотя с основаниями и оксидами металлов они способны реагировать).
С другой стороны, такие сильные кислоты как серная или соляная (хлороводородная) способны реагировать со всеми металлами из левой части табл. 4.3.
В связи с этим существует еще одна классификация кислот – по силе. В таблице 4.4 в каждой из колонок сила кислот уменьшается сверху вниз.
Таблица 4.4. Классификация кислот на сильные и слабые кислоты.
| Сильные кислоты | Слабые кислоты |
| HI иодоводородная | HF фтороводородная |
| HBr бромоводородная | H3PO4 фосфорная |
| HCl хлороводородная | H2SO3 сернистая |
| H2SO4 серная | H2S сероводородная |
| HNO3 азотная | H2CO3 угольная |
| HmnO4 | H2SiO3 кремниевая |
| H2CrO4 |
Следует помнить, что в реакциях кислот с металлами есть одно важное исключение. При взаимодействии металлов с азотной кислотой водород не выделяется. Это связано с тем, что азотная кислота содержит в своей молекуле сильный окислитель – азот в степени окисления +5. Поэтому с металлами в первую очередь реагирует более активный окислитель N+5, а не H+, как в других кислотах. Выделяющийся все же в каком-то количестве водород немедленно окисляется и не выделяется в виде газа. Это же наблюдается и для реакций концентрированной серной кислоты, в молекуле которой сера S+6 также выступает в роли главного окислителя. Состав продуктов в этих окислительно-восстановительных реакциях зависит от многих факторов: активности металла, концентрации кислоты, температуры. Например:
Cu + 4 HNO3(конц.) =Cu(NO3)2 + 2 NO2 + 2 H2O
3 Cu + 8HNO3(разб.) = 3 Cu(NO3)2 + 2 NO + 4 H2O
8 K + 5 H2SO4(конц.) = 4 K2SO4 + H2S + 4 H2O
3 Zn + 4 H2SO4(конц.) = 3 ZnSO4 + S + 4 H2O
Есть металлы, которые реагируют с разбавленными кислотами, но не реагирует с концентрированными (т.е. безводными) кислотами – серной кислотой и азотной кислотой.
Эти металлы – Al, Fe, Cr, Ni и некоторые другие – при контакте с безводными кислотами сразу же покрываются продуктами окисления (пассивируются). Продукты окисления, образующие прочные пленки, могут растворяться в водных растворах кислот, но нерастворимы в кислотах концентрированных.
Это обстоятельство используют в промышленности. Например, концентрированную серную кислоту хранят и перевозят в железных бочках.
Дата добавления: 2015-09-29; просмотров: 1669;
