Уравнение Менделеева–Клапейрона
Уравнение состояния вещества – уравнение, связывающее термодинамические параметры состояния вещества. Для идеального газа уравнение состояния называют уравнением Менделеева–Клапейрона.
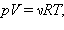
где p – давление газа; V – объём сосуда, в котором находится газ; ν – число молей газа; R – универсальная газовая постоянная; T – абсолютная температура газа. Рассмотрим подробнее некоторые параметры уравнения.
Количество вещества – отношение числа молекул в рассматриваемом теле к постоянной Авогадро:
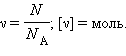
Постоянная Авогадро – число молекул в 1 моль вещества. 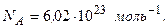
1 моль – количество вещества, содержащее столько же молекул, сколько атомов содержится в 12 г изотопа углерода 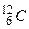 .
.
Количество вещества удобно находить через молярную массу – произведение массы молекул на постоянную Авогадро.
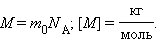
Молярная масса показывает массу 1 моль вещества и определяется через относительную атомную массу, указанную в таблице Менделеева:
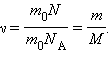
Тогда уравнение Менделеева–Клапейрона записывают следующим образом:
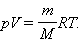
Уравнение Менделеева–Клапейрона выводится в школьном курсе физики из уравнения связи давления газа с абсолютной температурой:
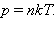
В процессе вывода получается произведение постоянной Больцмана на постоянную Авогадро, которое и назвали универсальной газовой постоянной:
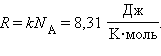
Уравнение Менделеева–Клапейрона позволяет находить плотность любого газа при известных его давлении и температуре.
Дата добавления: 2015-10-09; просмотров: 1600;
