Обмен жирных кислот
Высвобождающиеся при липолизе жирные кислоты поступают в кровоток и транспортируются в связанном с сывороточными альбуминами состоянии. Поступление СЖК сопровождается появлением в плазме также и глицерола. Глицерол может участвовать в глюконеогенезе или включаться в гликолитический путь с предварительным образованием глицерол-3-фосфата.
После того, как жирные кислоты поступают в клетку, они активируются путем образования кофермент А-производных:
RCOOH + HSKoA + ATФ ® RCO ~КоА + АМФ +ФФН
Реакцию катализируют ферменты ацил-КоА-синтетазы. Они находятся как в цитозоле, так и в матриксе митохондрий и отличаются по специфичности к жирным кислотам с различной длиной углеводородной цепи. Жирные кислоты с длиной цепи от 2 до 4 атомов углерода могут проникать в матрикс митохондрий путем диффузии. Активация таких кислот происходит в матриксе митохондрий. Жирные кислоты с длинной цепью, которые преобладают в организме человека, активируются ацил-КоА-синтетазами, расположенными на внешней мембране митохондрий.
β-Окисление жирных кислот происходит в матриксе митохондрий, поэтому после активации эти субстраты должны транспортироваться внутрь митохондрий. Этот процесс осуществляется с помощью карнитина, который поступает с пищей или синтезируется из незаменимых аминокислот лизина и метионина.
В наружной мембране митохондрий (Рис. 20.1) находится фермент карнитинацилтрансфераза I, катализирующий реакцию с образованием ацилкарнитина. Образовавшийся ацил-карнитин проходит через межмембранное пространство к наружной стороне внутренней мембраны и транспортируется с помощью карнитинацилкарнитин-транслоказы на внутреннюю поверхность внутренней мембраны митохондрий, где фермент карнитинацилтрансфераза II катализирует перенос ацила на внутримитохондриальный КоА. После этого ацил-КоА включается в реакции β-окисления. Свободный карнитин возвращается в межмембранное пространство той же транслоказой.
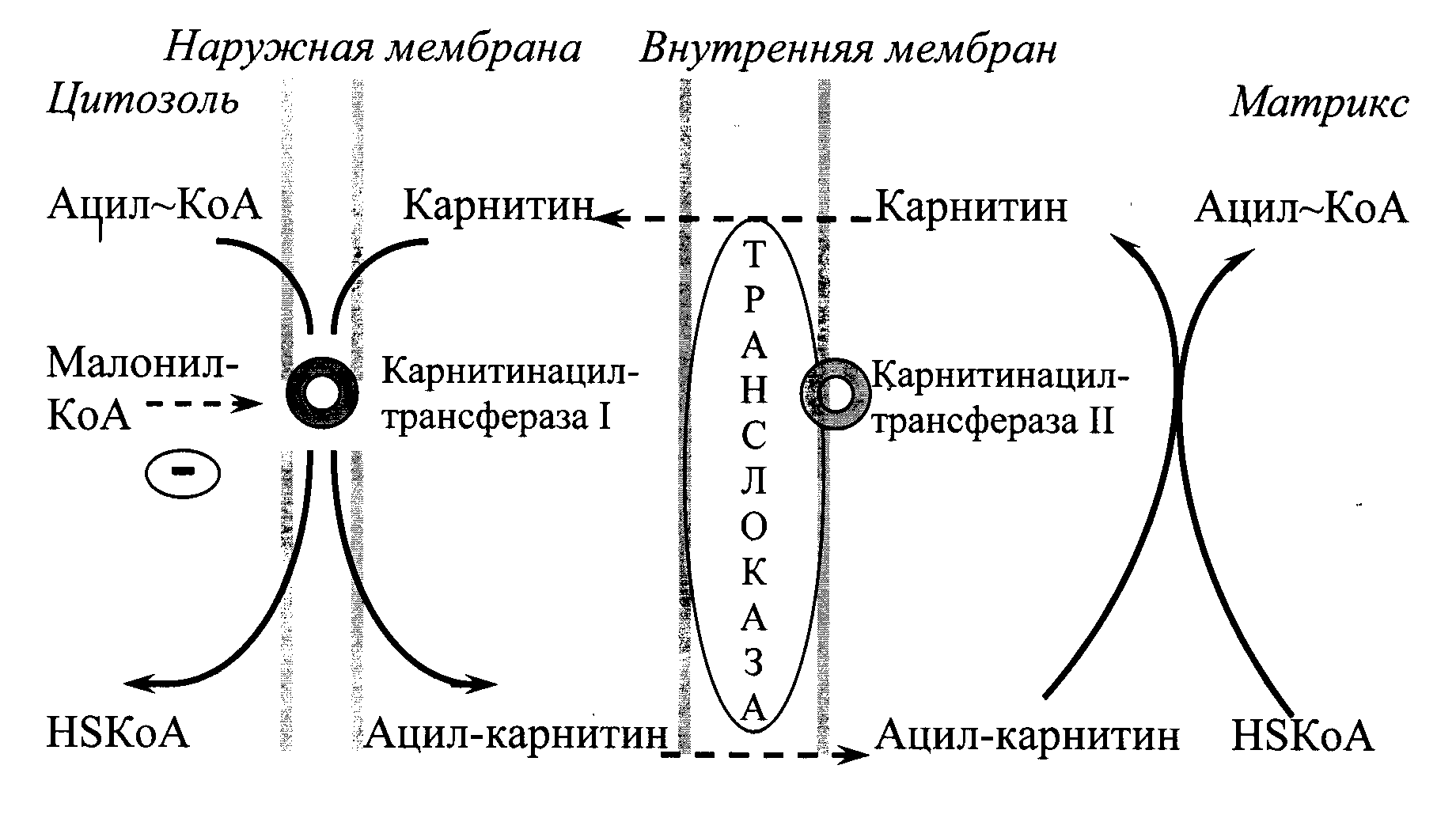
Рис. 20.1. Перенос длинноцепочечных жирных кислот через мембраны митохондрий.
β-Окисление жирных кислот – специфический путь катаболизма жирных кислот, протекающий в матриксе митохондрий только в аэробных условиях и заканчивающийся образованием ацетил-КоА. Водород из реакций β-окисления поступает в ЦТД, а ацетил-КоА окисляется в цикле трикарбоновых кислот, также поставляющем водород для ЦТД. Поэтому β-окисление жирных кислот является важнейшим метаболическим путем, обеспечивающим синтез АТФ в дыхательной цепи.
Продуктами каждого цикла β-окисления являются ФАДН2, НАДН и ацетил-КоА. Остаток кислоты, который входит в каждый последующий цикл, короче на 2 углеродных атома. В последнем цикле, когда остаётся жирная кислота из 4 атомов углерода, образуются сразу 2 молекулы ацетил-КоА. Суммарное уравнение β-окисления пальмитоил-КоА может быть представлено так:
С15Н31СО-КоА +7 ФАД+ 7 НАД++7 HSКоА ®8 СН3СО-КоА+7 ФАДН2+7 (НАДН+Н+).
Энергетический выход в этом случае составляет 131 молекулу АТФ (21 АТФ образуется при окислении каждой из 7 молекул НАДН в ЦТД, 14 – при окислении каждой из 7 молекул ФАДН2 в ЦТД, синтез 96 молекул АТФ обеспечивается окислением 8 молекул ацетил-КоА в ЦТК). С учетом расхода 1 молекулы АТФ на активцию кислоты, чистый энергетический выход окисления пальмитата составляет 130 АТФ. Окисление жирных кислот – важный источник энергии в тканях с высокой активностью ЦТК и дыхательной цепи (скелетные и сердечная мышцы, почки). Эритроциты, в которых отсутствуют митохондрии, не могут окислять жирные кислоты. Эти соединения не служат источником энергии для головного мозга, так как жирные кислоты не проходят через гематоэнцефалический барьер.
Регуляция скорости β-окисления. Скорость процесса регулируется потребностью клетки в энергии (соотношениями АТФ/АДФ, НАДН/НАД+). Скорость β-окисления зависит и от доступности субстрата, т.е. от количества жирных кислот, поступающих в митохондрии. Концентрация СЖК в крови повышается при активации липолиза. В этих условиях жирные кислоты становятся преимущественным источником энергии для мышц и печени, так как в результате β-окисления образуются НАДН и ацетил-КоА, ингибирующие пируватдегидрогеназный комплекс. Таким образом, использование жирных кислот как основного источника энергии в мышечной ткани и печени сберегает глюкозу для нервной ткани и эритроцитов.
Скорость β-окисления зависит также от активности карнитинацилтрансферазы I. В печени этот фермент ингибируется малонил-КоА, образующимся при биосинтезе жирных кислот. То есть малонил-КоА ингибирует деградацию жирных кислот, чем способствует их использованию для синтеза жира.
Другие типы окисления жирных кислот. β-Окисление является основным путем катаболизма жирных кислот, но помимо него встречаются α-окисление и ω–окисление. α-Окисление представляет собой последовательное отщепление одноуглеродных фрагментов, выделяющихся в виде СО2 от карбоксильного конца молекулы. Такому типу окисления подвергаются жирные кислоты с цепью более 20 углеродных атомов (характерны для липидов нервной ткани), а также жирные кислоты с разветвленной углеродной цепью (поступают с пищей). ω–Окисление жирных кислот в норме весьма незначительно, происходит оно в микросомах печени. Первоначальная стадия катализируется монооксигеназой, которая тебует наличия НАДФН, О2 и цитохрома Р-450. Группа -СН3 при этом превращается в -СН2ОН, затем окисляется до –СООН. Образовавшаяся дикарбоновая кислота может быть укорочена с любого конца путем реакций β-окисления.
Окисление ненасыщенных жирных кислот идет обычным путем, до тех пор, пока двойная связь не окажется между третьим и четвертым атомами углерода. После этого фермент еноил-КоА-изомераза перемещает двойную связь из положения 3-4 в положение 2-3 и изменяет цис-конформацию двойной связи на транс-, которая требуется для β-окисления. В этом цикле β-окисления первая реакция дегидрирования не происходит, так как двойная связь в радикале жирной кислоты уже имеется. Далее циклы β-окисления продолжаются, не отличаясь от обычного пути.
Жирные кислоты с нечетным числом углеродных атомов на конечном этапе β-окисления образуют ацетил-КоА и пропионил-КоА. Трехуглеродный фрагмент в ходе трех реакций превращается в сукцинил-КоА – метаболит ЦТК.
Ацетил-КоА, образующийся при β-окислении жирных кислот, расщеплении кетогенных аминокислот и окислительном декарбоксилировании пирувата служит исходным субстратом для ряда важнейших метаболических путей: 1) окисление в ЦТК, 2) образование кетоновых тел, 3) биосинтез холестерола, 4) биосинтез жирных кислот.
Дата добавления: 2015-10-05; просмотров: 852;
