Химия железа и его соединений
Железо является вторым после алюминия металлом по распространенности в природе. Основные руды: магнетит Fe3O4, гематит Fe2O3, лимонит 2Fe2O3×3H2O, пирит FeS2. Из руд железо получают восстановлением углеродом в домнах. Получаемое при этом железо содержит около 4% углерода и называется чугуном. При переработке чугуна получают стали, в которых содержание углерода составляет 0,2-2,0%.
Железо является достаточно активным металлом и растворяется в соляной и разбавленных азотной и серной кислотах.
Fe + 2HCl ® FeCl2 + H2
Fe + H2SO4 (разб.) ® FeSO4 + H2
Fe + HNO3 (разб.) ® Fe(NO3)3 + NO + H2O
Концентрированные серная и азотная кислоты на холоду пассивируют железо (как и алюминий, и хром)
Нерастворимый в воде оксид железа(II) FeO имеет основные свойства и растворяется в кислотах, но не в щелочах:
FeO + H2O ¹
FeO + H2SO4 ® FeSO4 + H2O
Зеленоватый осадок гидроксида железа(II) Fe(OH)2 получают действием щелочей на соли железа(II).
FeSO4 + 2NaOH ® Fe(OH)2¯ + Na2SO4
Fe(OH)2 имеет основные свойства:
Fe(OH)2¯ + Н2SO4 ® FeSO4 + 2H2O
Fe(OH)2¯ + 2NaOH ¹
и легко окисляется кислородом воздуха до бурого гидроксида железа (III), проявляя восстановительные свойства:
4Fe(OH)2¯ + 2H2O + O2 ® 4Fe(OH)3¯
Красно-бурый осадок гидроксида железа(III) Fe(OH)3 получают действием щелочей на соли железа(III).
FeCl3 + 3NaOH ® Fe(OH)3¯ + 3NaCl
Гидроксид железа (III) имеет амфотерные свойства. Его основные свойства слабее, чем у Fe(OH)2, а его кислотные свойства слабее его основных свойств и проявляются лишь в очень жестких условия, например, при сплавлении.
Fe(OH)3¯ + 3HCl ® FeCl3 + 3H2O
Fe(OH)3¯ + NaOH ¹ не идет в растворе
Fe(OH)3¯ + NaOH 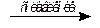 NaFeO2 + H2O
NaFeO2 + H2O
В кислой среде ионы железа(III) являются окислителями и переходят в ионы железа(II):
FeCl3 + 2HI ®2FeCl2 + I2 + 2HCl
В щелочной среде сплавлением с нитратом калия из соединений железа(III) могут быть получены соединения железа(III) - соли железной кислоты - ферраты:
Fe2O3 + 3KNO3 + 4KOH 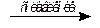 2K2FeO4 + 3KNO2 + 2H2O
2K2FeO4 + 3KNO2 + 2H2O
Ионы железа(II) и железа(III) образуют многочисленные комплексные соединения с молекулами воды, аммиака, ионами Cl-, F-, CN-, SCN- и другими лигандами:
FeSO4 + 6KCN ® K4[Fe(CN)6] + K2SO4
FeCl3 + 6KCN ® K3[Fe(CN)6] + 3KCl
Интенсивная кроваво-красная окраска роданида железа(III) Fe(SCN)3 служит для обнаружения ионов железа(III) в растворе.
FeCl3 + 3KCNS ® Fe(SCN)3 + 3KCl
Гексациано(II)феррат калия K4[Fe(CN)6] образует с ионами железа(III) темно-синий осадок берлинской лазури, что также используется для обнаружения ионов железа(III) в растворе:
K4[Fe(CN)6] + FeCl3 ® KFe[Fe(CN)6]¯ + 3KCl
Гексациано(III)феррат калия K3[Fe(CN)6] образует с ионами железа(II) темно-синий осадок турнбулевой сини, что используется для обнаружения ионов железа(II) в растворе:
K3[Fe(CN)6] + FeSO4 ® KFe[Fe(CN)6]¯ + K2SO4
Биологическое значение железа велико, железо - составная часть гемоглобина крови.
Дата добавления: 2015-09-07; просмотров: 1136;
