Химия брома, иода и их соединений
В природе бром и иод находятся в виде солей (NaBr, NaI и др.). Их получают действием хлора на растворы этих солей:
2NaBr + Cl2 ® 2NaCl + Br2
2NaI + Cl2 ® 2NaCl + I2
Если хлор - газ, то бром - темно-бурая жидкость с резким запахом, а иод - кристаллическое вещество темного цвета. Изменение фазового состояния галогенов обусловлено увеличением межмолекулярного - дисперсионного взаимодействия, связанного с увеличением размеров и поляризуемости молекул галогенов в ряду хлор ® бром ® иод.
Бром и иод взаимодействуют со многими металлами:
2Al + 3Br2 ® 2AlBr3
2Al + 3I2 ® 2AlI3
Окислительная способность галогенов уменьшается от фтора к иоду. Так взаимодействие брома с водородом идет лишь при температуре более 300оС, а взаимодействие иода с водородом не идет до конца и является обратимым процессом:
Br2 + H2 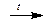 2HBr
2HBr
I2 + H2  2HI
2HI
Растворы бромоводорода и иодоводорода в воде являются сильными кислотами. Сила кислот растет в ряду HCl - HBr - HI в связи с увеличением размеров и поляризуемостей этих молекул. Соли этих кислот (бромиды и иодиды) хорошо растворимы в воде. Лишь галогениды серебра малорастворимы в воде.
AgNO3 + NaBr ® AgBr¯ + NaNO3
AgNO3 + NaI ® AgI¯ + NaNO3
Бром и иод хорошо растворимы в органических растворителях и могут быть экстрагированы ими из водных растворов. Раствор брома в толуоле или четыреххлористом углероде оранжевый, раствор иода - фиолетовый. С крахмалом иод дает темно-синее окрашивание, исчезающее при нагревании и появляющееся вновь при охлаждении. Восстановительные свойства галогенид-ионов увеличиваются в ряду Cl- ® Br- ® I- и иодид-ион является сильным восстановителем.
10KI + 8H2SO4 + 2KMnO4 ® 5I2 + 2MnSO4 + 6K2SO4 + 8H2O
Дата добавления: 2015-09-07; просмотров: 1531;
