Химия хрома и его соединений
В природе хром находится в виде хромового железняка FeO×Cr2O3
или Fe(CrO2)2. Хром получают восстановлением хромового железняка углем в электрических печах в виде феррохрома, содержащего 60-65% хрома:
FeO×Cr2O3 + 4CO ® Fe + 2Cr + 4CO2
Чистый хром может быть получен электролизом растворов или расплавов солей, методом алюминотермии из оксида хрома(III):
Cr2O3 + 2Al 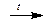 2Cr + Al2O3
2Cr + Al2O3
Хром представляет собой ковкий тягучий металл серо-стального цвета.
В степени окисления +2 соединения хрома проявляют основные свойства и являются восстановителями - легко окисляются до более высоких степеней окисления.
Оксид хрома(III) может быть получен разложением дихромата аммония при нагревании:
(NH4)2Cr2O7 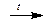 N2 + Cr2O3 + 4H2O
N2 + Cr2O3 + 4H2O
Соответствующий ему нерастворимый гидроксид хрома (III) получают при действии недостатка щелочей на соли хрома(III):
СrCl3 + 3NaOH ® Cr(OH)3¯ + 3NaCl
Серо-зеленый гидроксид хрома (III) имеет амфотерные свойства:
Cr(OH)3¯ + 3HCl ® CrCl3 + 3H2O
Cr(OH)3¯ +3NaOH ® Na3[Cr(OH)6]
Соединения хрома (III) в щелочной среде имеют восстановительные свойства и окисляются бромом, пероксидом водорода или другими окислителями. Зеленый раствор гексагидроксохромата(III) натрия желтеет вследствие образования хромата натрия:
2Na3[Cr(OH)6] + 4NaOH + 3Br2 ® 2Na2CrO4 + 6NaBr + 8H2O
Оксид хрома(VI) имеет кислотные свойства. Ему соответствуют две кислоты: хромовая H2CrO4 и дихромовая H2Cr2O7:
CrO3 + H2O ® H2CrO4
2CrO3 + H2O ® H2Cr2O7
В водных растворах между желтыми хромат ионами и оранжевыми дихромат ионами наблюдается равновесие:
2CrO42- + 2H+ ® Cr2O72- + H2O
Это равновесие в кислой среде сдвигается в сторону образования дихромат-ионов, а в щелочной среде - в сторону хромат-ионов:
2K2CrO4 + H2SO4 ® K2Cr2O7 + K2SO4 + H2O
K2Cr2O7 + 2KOH ® 2K2CrO4 + H2O
Существующие в кислой среде дихроматы являются сильными окислителями, восстанавливаясь до соединений хрома(III):
K2Cr2O7 + 4H2SO4 + 3K2SO3 ® Cr2(SO4)3 + 4K2SO4 + 4H2O
K2Cr2O7 + 7H2SO4 + 6KI ® Cr2(SO4)3 + 3I2 + 4K2SO4 + 7H2O
Дата добавления: 2015-09-07; просмотров: 1023;
