Свойства алюминия и его соединений
В промышленности алюминий получают электролизом расплава боксита Al2O3 в криолите Na3AlF6 при 960оС.
Al2O3  Al3+ + AlO33-
Al3+ + AlO33-
На катоде идет восстановление: Al3+ + 3е ® Al
На аноде идет окисление: 4AlO33- - 12е ® 3О2 + 2Al2O3
Алюминий покрыт инертной защитной пленкой Al2O3. Без оксидной пленки Al очень активен и взаимодействует с кислородом и водой:
4Al + 3O2 ® 2Al2O3
2Al + 6H2O ® 2Al(OH)3 + 3H2
Алюминий взаимодействует с кислотами и щелочами:
2Al + 6HCl ® 2AlCl3 + 3H2
2Al + 6NaOH + 6H2O ® Na3[Al(OH)6] + 3H2
Оксид алюминия имеет амфотерные свойства:
Al2O3 + H2O ¹
Al2O3 + 6HCl ® 2AlCl3 + 3H2O
Al2O3 + 2NaOH 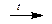 2NaAlO2 + H2O
2NaAlO2 + H2O
Гидроксид алюминия можно получить из солей действием гидроксида аммония или действием недостатка щелочи. Гидроксид алюминия имеет амфотерные свойства.
AlCl3 + 3NH4OH ® Al(OH)3¯ + 3NH4Cl
AlCl3 + 3NaOH ® Al(OH)3¯ + 3NaCl
Al(OH)3¯ + 3NaOH ® Na3[Al(OH)6]
Al(OH)3¯ + 3HCl ® AlCl3 + 3H2O
Соли алюминия гидролизуются. Некоторые из них (Al2S3, Al2(CO3)3) полностью разлагаются водой.
Al2S3 + 6H2O ® 2Al(OH)3 + 3H2S
Алюминий используется для получения металлов - метод алюминотермии. Термитная смесь Al + Fe3O4 при поджигании выделяет большое количество энергии, получаемое железо при этом расплавляется.
8Al + 3Fe3O4 ® 9Fe + 4Al2O3
Алюминий широко применяется как конструкционный материал, а также в электротехнике. Соединения индия и таллия ядовиты. Так сульфат таллия используется как зооцид для борьбы с грызунами.
Дата добавления: 2015-09-07; просмотров: 970;
