ГИБРИДИЗАЦИЯ АТОМНЫХ ОРБИТАЛЕЙ
Согласно квантово-механическим представлениям о химической связи число образуемых атомом ковалентных связей определяется количеством одноэлектронных атомных орбиталей. то есть количеством нес паренных электронов. Однако в действительности атомы элементов образуют большее число ковалентных связей, чем содержат неспаренных электронов на внешнем энергетическом уровне. Например, атом углерода в основном состоянии имеет два неспаренных электрона (1s22s22p2), а образует четыре ковалентных связи. Это можно объяснить возможностью перехода 2s-электрона на 2p-подуровень (1s22s12p3).
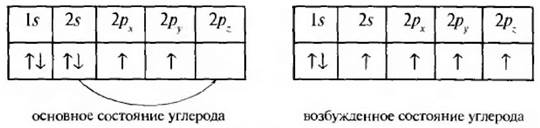
Таким образом, на внешнем энергетическом уровне атома углерода находятся четыре неспаренных электрона: один-s и три-p. Поскольку химические связи образуются валентными электронами, то связи, например, в молекуле метана CH4 должны были бы быть неравноценными: одна связь С-Н образована s-электроном, а три остальные – р. В действительности в молекуле метана все связи совершенно равноценны. Для объяснения этого факта в квантовой механике вводится понятие о гибридизации атомных орбиталей (АО). Слово гибридизация означает взаимодействие, перекрывание, перемешивание. При взаимодействии одного s-электронного облака с тремя p-электронными облаками образуются четыре качественно новых гибридизированных электронных облака или атомные орбитали:
1s +3р = 4sp3
Таким образом, из нескольких различных по форме и близких по энергии АО путем комбинирования (смешивания, сочетания) образуется такое же количество одинаковых по форме и равных по энергии гибридизованных атомных орбиталей:

Гибрилизованные орбитали по сравнению с негибридизованны-ми более выгодны геометрически, т. к. позволяют увеличить плошадь перекрывания с орбиталями других атомов, что ведет к образованию более прочных связей. Результатом перекрывания большей доли гибридной орбитали с орбиталями других атомов является ковалентная связь.
Атом углерода характеризуется тремя видами гибридизации с участием s- и р-орбиталей, каждому из которых соответствует определенное валентное состояние атома.
Первое валентное состояние углерода (sp3-гибридизация). Образование с-связи.
Состояние sp3--гибридизации – результат взаимодействия одной s- и трех р-атомных орбиталей.
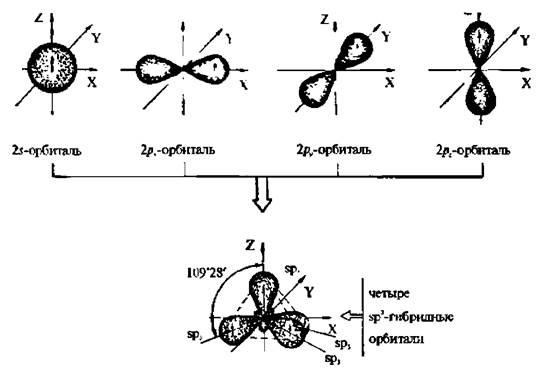
Рис. 2.2. Схема образования и расположение в пространстве гибридных sр3-орбиталей
Четыре равноценные орбитали между собой образуют угол 109о28' и ориентированы в пространстве от центра правильного тетраэдра к его вершинам. Такое размещение связано со стремлением АО к максимальному удалению друг от друга за счет взаимного электростатического отталкивания. Расположение атомных орбиталей определяет название состояния sp3 гибридизации как тетраэдрическое.
Доля s-облака в каждой из четырех гибридных sp3--орбиталей равна 1/4 В результате перекрывания таких орбиталей с другими орбиталями (s, р, d и гибридными sp3, sp2, sp) вдоль линии, соединяющей центры атомов, образуются только простые ковалентные связи – σ (греч. «сигма») связи. Перекрывание атомных орбиталей вдоль линии, соединяющей центры атомов, называют σ-перекрыванием или осевым, так как максимальная электронная плотность при этом находится на оси, соединяющей два ядра.
Состояние sp3-гибридизации характерно для алканов. Рассмотрим образование σ-связей на примере этана.
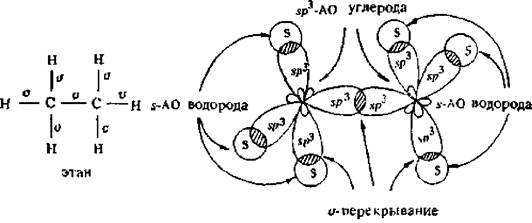
Рис. 2.3. Образование σ-синзей в молекуле этана
В этане в результате осевого s – sp3-перекрывания образуются шесть С–Н σ-связей, а за счет перекрывания sp3- sp3 -орбиталей – одна С–С связь.
о-Связи во многих органических соединениях образуются преимущественно за счет перекрывания гибридизованных sp3, sp2, sp-орбиталей.
Второе валентное состояние углерода (sp2-гнбридцзация). π-Связи
Состояние sp2-гибридизации – результат взаимодействия одной s- и двух р-орбиталей (рx- ру).
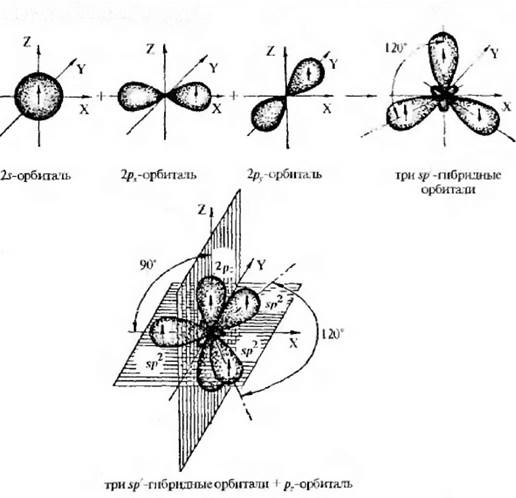
Рис. 2.4. Строение атома углерода в sp3-гибридизации
Образованные три эквивалентные sp2-гибридные орбитали находятся в одной плоскости под углом 120ο поэтому sp2 -гибридизация называется тритональной Негибридизованная рz-орбиталь расположена в плоскости, которая перпендикулярна плоскости расположения гибридных орбиталей. Условно доля s-облака в каждой из трех sр2-гибридных орбиталей равна 1/3 Такая гибридизация характерна для соединений с двойными связями, например, для этилена.
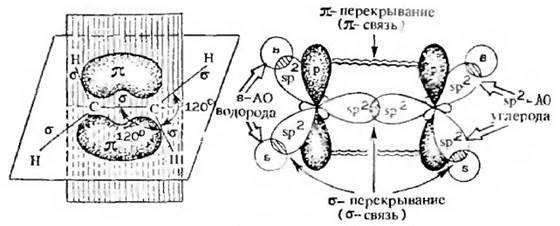
Рис. 2.5. Образование π-связи в молекуле этилена
Атомы углерода в этилене находятся в sp2-гибридизации. Перекрывание трех гибридных орбиталей каждого из углеродов дает σ-связи (четыре С-Н и одну С-С). Кроме того, перекрывание двух негибридизованных p-орбиталей в плоскости, перпендикулярной плоскости σ-связи, называют π-перекрываннем, а образующаяся в результате связь – π-связью. Ее максимальная электронная плотность сконцентрирована в двух областях – выше и ниже оси, соединяющей центры атомов. π-Связь менее прочна, чем σ. π-Связь образуется только между атомами, которые находятся в sp1- или sp2-гибридизации.
Третье валентное состояние (sp-гибриднзация)
Состояние sp-гибрнлизации – результат взаимодействия одной s- и одной p-орбитали (рx).
sp-Гибридизацию называют еще линейной потому, что две sp-гибридные орбитали расположены под углом 180е. Остальные две негибридизованные рy- и рz-орбитали находятся в двух взаимно перпендикулярных плоскостях и расположены под прямым углом к sp-гибридным орбиталям. Доля s-облака в каждой из двух гибридных sp-орбиталей равна 1/2. Такой тип гибридизации характерен для соединений с тройной связью, например, для ацетилена.
В молекуле ацетилена sp-гибрилизованные атомы образуют две простые С–Н σ-связи и одну тройную связь между двумя атомами углерода, которая состоит из одной σ- и двух π-связей, расположенных во взаимно перпендикулярных плоскостях.
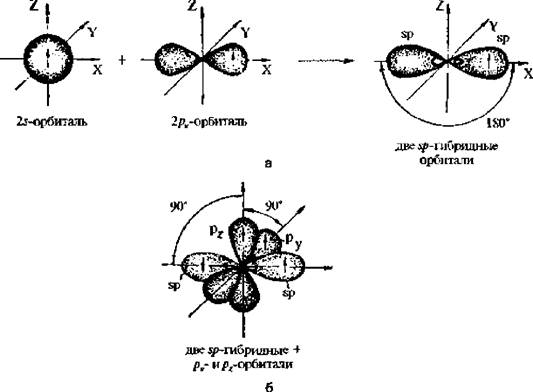
Рис. 2.6. Строение атома углерода в sр-гибридизации; а –схема образования гибридных sp-орбиталей; б –взаимное размещение орбиталей при sp-гибридизации
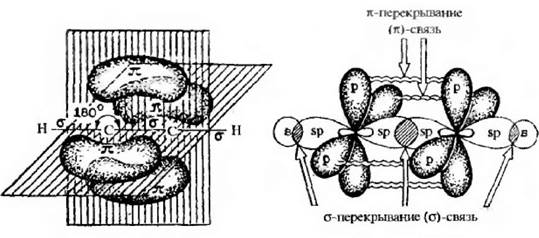
Рис 2.7. Образование π-связи в молекуле ацетилена
Дата добавления: 2015-09-29; просмотров: 4384;
