Теоретические основы. По агрегатному состоянию вещества бывают твердые, жидкие и газообразные
По агрегатному состоянию вещества бывают твердые, жидкие и газообразные. Для одного и того же вещества каждое из данных состояний можно назвать фазой.
Фаза – химически или физически однородная часть какой-то системы, имеющая одинаковые структурные характеристики и свойства и отделенная от других поверхностью раздела, при переходе через которую свойства и состав изменяются скачкообразно.
Системы могут быть одно или многофазными, частным случаем являются двухфазные. Большинство веществ могут находиться во всех данных состояниях. Поэтому для широкого числа соединений возможен переход из одной фазы в другую. Такие трансформации называются фазовыми изменениями или превращениями. Они обуславливаются различием свободной энергии каждого состояния.
Согласно основному соотношению термодинамики DG = DH – TDS, объединяющему в себе первый и второй ее законы, каждая система стремится к минимальному значению термодинамического потенциала (G), где (H) – энтальпия системы, Т – абсолютная температура состояния, S – энтропия.
При производстве металла наблюдается переход из жидкого в твердое кристаллическое состояние, называемый кристаллизацией. Жидкая фаза характеризуется беспорядочным (хаотичным) движением структурных единиц системы в своем объеме. Она обладает низкой свободной энергией или термодинамическим потенциалом. Твердое тело имеет упорядоченное расположение ядер в структуре, практически спокойное состояние. Термодинамический потенциал такой системы имеет более высокие значения, а кинетическая энергия ее самая маленькая.
Кристаллизация металла обусловлена его стремлением иметь более устойчивое состояние, характеризуемое уменьшением энтропийного фактора в доле свободной энергии. Изменение свободных энергий жидкого и твердого состояний в зависимости от температуры модифицируется по сложному и различному для данных фаз закону (рис. 1.12). Выше точки пересечения кривых жидкой и твердой фаз более устойчив металл в жидком состоянии, имеющий меньший запас свободной энергии, ниже - более стойкой является твердая фаза. В самой данной точке величины G жидкого и твердого состояний равны. Температура, соответствующая таковому состоянию, называется равновесной (теоретической) температурой плавления или кристаллизации. При ней обе фазы могут существовать одновременно и притом бесконечно долго. Для начала кристаллизации необходимо, чтобы процесс был термодинамически выгоден системе и сопровождался уменьшением хотя бы одной из составляющих свободной энергии. Процесс кристаллизации может начаться только тогда, когда металл остынет до температуры ниже равновесной, т. е. произойдет его переохлаждение. Это вызвано тем, что образование и рост кристаллов сопровождается выделением избыточного количества свободной энергии. Разность между данными температурами называется степенью переохлаждения (DТ). Она зависит от природы металла. Степень переохлаждения увеличивается с повышением чистоты металла и с ростом скорости остывания. Обычно при кристаллизации в производственных условиях ее значения колеблются от 10 до 30 °С; при больших же скоростях охлаждения она может достигать сотен градусов (рис. 1.12).
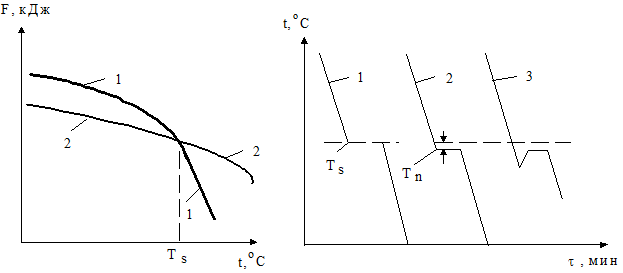
| |
| Рис. 1.12 - Зависимость изменения свободной энергии фазовых состояний от температуры: 1- жидкость, 2 – твердое тело | Рис. 1.13 - Кинетические кривые процесса охлаждения для: 1 – идеального, 2 и 3 – реального металлов |
Процесс перехода металла из жидкого состояния в кристаллическое описывается кинетическими кривыми в координатах температура – время (рис. 1.13).
При очень медленном остывании металла его степень переохлаждения мала и процесс кристаллизации протекает при температуре близкой к равновесной. Далее при достижении точки равновесия на графике отмечается горизонтальная площадка - плато (остановка в понижении температуры), образование которой объясняется выделением скрытой теплоты кристаллизации. С увеличением скорости охлаждения степень переохлаждения возрастает, и процесс кристаллизации протекает при температурах ниже равновесной.
Дата добавления: 2015-09-21; просмотров: 1020;
