Энтропия как мера дезорганизации
Энтропия (от греч. – поворот, превращение, обозначается S) – это однозначная функция состояния термодинамической системы; изменение энтропии ( 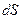 ) в равновесном процессе равно отношению количества теплоты (
) в равновесном процессе равно отношению количества теплоты ( 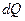 ), сообщенного системе или отведенного от нее к термодинамической температуре (Т) системы. Неравновесные процессы в изолированной системе сопровождаются ростом энтропии, они приближают систему к состоянию равновесия, в котором S максимальна. Понятие «энтропия» введено в 1865 г. Р. Клаузиусом. Систематическая физика рассматривает энтропию как меру вероятности пребывания системы в данном состоянии (принцип Больцмана).
), сообщенного системе или отведенного от нее к термодинамической температуре (Т) системы. Неравновесные процессы в изолированной системе сопровождаются ростом энтропии, они приближают систему к состоянию равновесия, в котором S максимальна. Понятие «энтропия» введено в 1865 г. Р. Клаузиусом. Систематическая физика рассматривает энтропию как меру вероятности пребывания системы в данном состоянии (принцип Больцмана).
Чем меньше энтропия – тем больше упорядоченность и наоборот. Эволюция понятий энтропии представлена на рис. 15.

Рис.15. Эволюция представлений об энтропии
3.3.8. Современная физическая картина мира
Впервые физическую картину мира (ФКМ) представил Сухонос С. в 1981 г., которая приведена на рис. 16.
Посредством шкалирования он выяснил, что размеры электронов, атомов, человека, звезд и галактик отличаются друг от друга на 10 порядков. Аналогично отличаются и размеры ядер атомов, клеток, звезд и т.д. Это означает, что в распределении различных уровней мироздания есть некоторая упорядоченность.
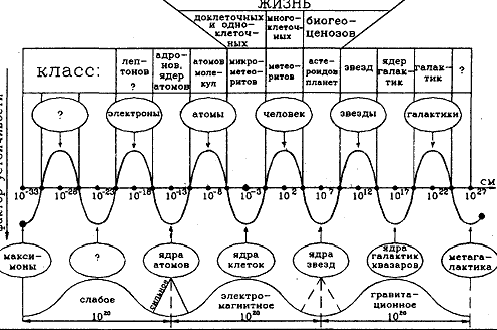
Рис. 16. Современная физическая картина мира
Все существующие силы в природе определяются тем или иным типом взаимодействий. И, несмотря на кажущееся их множество, до сих пор обнаружено лишьчетыре вида фундаментальных взаимодействий: гравитационные, слабые, электромагнитные, сильные (ядерные).
Таблица 7
Дата добавления: 2015-09-21; просмотров: 838;
