Понятие об энтропии. Энтропия идеального газа
Для цикла Карно из формул (10.17) и (10.21) легко получить соотношение
Q1 /T1 - Q2 /T2 = 0. (10.22)
Величину Q/T называют приведенной теплотой, где Q - количество тепла, переданного телу при температуре T . Из соотношения (10.22) следует, что для цикла Карно, являющегося обратимым, алгебраическая сумма приведенных теплот равна нулю. Понятие приведенных теплот можно применить для анализа произвольных тепловых процессов. Так как температура тел T изменяется во время процессов, то рассматривают малое количество передаваемой теплоты dQ и вводят новую величину S , называемуюэнтропией, элементарное изменение которой равно
dS = dQ / T. (10.23)
При переходе системы из состояния 1 в состояние 2 полное изменение энтропии
DS = S2 - S1 =  =
= 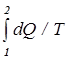 . (10.24)
. (10.24)
Рассчитаем изменение энтропии для идеального газа массой m . По первому началу термодинамики dQ = dU + dA . Подставляя dQ в (10.23) и учитывая, что в согласии с (10.9) dU = (m /m)Cv dT и dA = pdV , получим
dS = (m /m)Cv dT/T + pdV/T . (10.25)
Выразив p из уравнения pV = (m /m)RT и подставляя его в (10.25), а затем, подставив это равенство в (10.24), получим
S2 - S1 = (m /m)Cv  + (m /m)R
+ (m /m)R 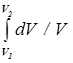
или после интегрирования
S2 - S1 = (m /m)Cv ln(T2 /T1) + (m /m)R ln(V2 /V1). (10.26)
Из выражения (10.26) следует, что энтропия зависит лишь от параметров V и T , т.е. является функцией состояния системы. Это означает, что если система совершит некоторые процессы и вернется в итоге к тем же параметрам V и T , то и энтропия ее примет прежнее значение.
Дата добавления: 2015-11-04; просмотров: 1056;
