Нарушения метаболизма кальция
Кальций — основной минерал скелета человека и самый распространенный катион организма. Общее количество Са в организме составляет 1–1,5 кг. Примерно 99% Са находится в костях в твердых тканях зубов в виде кристаллов гидроксиаппатита, а около 1% содержится во внутри- и неклеточной жидкостях. До 1% Са скелета свободно обменивается с Са внеклеточной жидкости, что составляет обменивающийся пул Са (2% от общего количества Са в организме).
Суточная потребность в кальции составляет 0,8–1,0 г у взрослого человека. Са поступает в организм с пищей (особенно богаты Са молочные продукты); 60–80% его всасывается в кишечнике. Выводится Са из организма с мочой (100–200 мг/сут), с калом и небольшое количество с потом.
В плазме крови Са находится в ионизированной форме (~50% кальция плазмы), связанной с белками (~40%) (в основном с альбумином) и в комплексе с небелковыми анионами (до 10%).
Биологической активной формой кальция является только ионизированный кальций. На количество ионизированного Са влияют прежде всего рН плазмы крови и содержание в ней фосфора. При алкалозах оно снижается, и у больных могут появляться признаки гипокальциемии, несмотря на нормальное общее содержание кальция. Напротив, при ацидозах оно повышается. Отношения между фосфором плазмы и количеством ионизированного Са также реципрокные. Изменение уровня альбумина плазмы влияет на общее содержание Са в сыворотке, но содержание ионизированного кальция может не изменяться.
Функции Са в организме многообразны: кроме механической (минеральные соли костей и зубов), Са участвует в процессах гемостаза, в регуляции нервно-мышечной возбудимости, является стабилизатором клеточных мембран, а также выступает в качестве внутриклеточного посредника при трансдукции клеточного сигнала.
Специальные мембранные переносчики (Са2+–АТФазы) создают трансмембранный градиент, позволяющий при физиологических процессах с огромной скоростью входить ионам Са в клетку через открытые каналы и вызывать преходящее повышение их цитоплазматической концентрации (кальциевый транзит). Связываясь с разнообразными белковыми структурами клетки и меняя их конформацию, ионы кальция получают возможность запустить или модулировать практически все жизненные функции клетки.
Потенциалуправляемые мембранные каналы для ионов кальция могут быть разделены на две основные функциональные группы: низко- и высокопороговые. Низкопороговые каналы (Т-типа) чрезвычайно варьируют в различных типах клеток. Важной их особенностью является нечувствительность к основным типам кальциевых блокаторов. Напротив, L-тип высокопороговых каналов является мишенью для блокаторов кальциевых каналов, активируется при сильной деполяризации и отличается невысокой скоростью транспорта ионов.
Различают три фракции внутриклеточного кальция. Первая локализуется внутри органелл (саркоплазматическая, эндоплазматического ретикулума митохондрий, ядра); вторая связана с анионами и белками; третья — свободный (ионизированный) Са2+, обладает биологической активностью и контролируется специальными транспортными системами.
Повышенная внутриклеточная концентрация кальция через стимуляцию кальмодулинзависимой протеинкиназы активирует сокращение гладких мышц, например, бронхов, секрецию тучных клеток легких, образование трахеобронхиального секрета.
В концентрации 10–4–10–5 М ионы Са оказывают прооксидантное действие, вероятно, обусловленное увеличением содержания в клетке ионизированного Fe и модификацией фосфолипидного состава мембран. При повреждении мембран усиливается ток ионов кальция в клетку, и нарастает его концентрация в ней; создаются условия для нарушения метаболизма цАМФ, активации ПОЛ, что влияет на функции клеток.
Основными гомонами, регулирубщими обмен Са, являются:
¾ паратиреокринин, или паратгормон, секретируемымй паращитовидными железами;
¾ кальцитонин, продуцируемый С-клетками щитовидной железы;
¾ кальцитриол (активная форма витамина Д, образующаяся в почках).
Главные органы-мишени и эффекты действия кальций-регулирующих гомонов представлены на рис. 12.
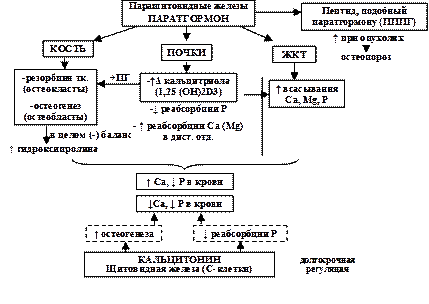
Рис. 12. Гормональная регуляция кальций-фосфорно-магниевого обмена
В норме содержание кальция в плазме крови составляет 2,1–2,5 ммоль/л, а ионизированного кальция (Са2+) — 0,84–1,26 ммоль/л.
Гипокальциемия— уменьшение содержания кальция в сыворотке крови ниже 2,1 ммоль/л.
Причины гипокальциемиии:
¾ снижение всасывания Са в кишечнике:
— недостаточное поступление с пищей Са и витамина Д;
— нарушение метаболизма витамина Д (снижение образования кальцитриола);
— хронические энтериты, синдром мальабсорбции;
— гипопаратиреоз (врожденный или приобретенный);
— гиперфосфатемия (например, при почечной недостаточности);
— гипомагниемия (тормозит секрецию партагормона и эффекты его и витамина Д в костной ткани);
— повышенное потребления кальция в периоды беременности и лактации, особенно при недостаточном его введении;
— снижение количества ионизированного кальция:
— хронический некомпенсированный алкалоз;
— переливание большого количества цитратной крови;
— гемодилюция (возмещение потери крови введением физиологического раствора внутривенно).
Проявления гипокальциемии
Ранними признаками гипокальциемии являются парестезии губ, носа, пальцев и повышение нервно-мышечной возбудимости. Отмечаются головокружение, резкая слабость, пароксизмальная тахикардия, гиперактивные рефлексы и судороги мышц. Частыми клиническими проявлениями являются тетания — спастическое сокращение мышц рук, ног и спазмофилия — спазм бронхов, пищевода, желудка, кишечника, проявляющиеся рвотой, болью в животе, запорами.
При нарушении обмена Са отмечаются системный остеопороз, эрозия зубной эмали; зубы декальцинируются, развивается резорбция корней. Повышается хрупкость костей скелета (переломы); зубы, лишенные дентина и эмали, легко и рано инфицируются, вплоть до альвеолярной пиореи. Кожа сухая, грубая, волосы ломкие (проявление дистрофии). Отмечаются гипокоагуляция и геморрагический синдром.
Гиперкальциемия — увеличение содержания кальция в плазме крови более 2,6 ммоль/л.
Причины гиперкальциемии:
— увеличение количества ионизированнго кальция:
— ацидоз;
— повышение поступления Са в организм:
— чрезмерная инфузия растворов солей Са;
— увеличение всасывания кальция в кишечнике:
— гиперпаратиреоз;
— передозировка витаминов Д и А;
— Повышенный выход Са из костей в кровь:
— гиперпаратиреоз;
— злокачественные опухоли (продукция клетками ПППГ и цитокинов, активирующих остеокласты);
— длительная иммобилизация;
— ацидоз (в обмен на Н+);
— Снижение экскреции Са с мочой:
— почечная недостаточность;
— прием тиазидных диуретиков.
Клинические проявления
В острых случаях гиперкальциемии возникают снижение нервно-мышечной возбудимости, слабость скелетных и гладких мышц, ухудшение координации, изменение походки, адинамия. Появляется заторможенность, нарушается память, отмечается спутанность сознания и другие нервно-психические расстройства вплоть до изменения личности, ступора и комы.
Гиперкальциемия потенцирует эффект сердечных гликозидов, поэтому возможны симптомы дигиталисной интоксикации, а также нарушения возбудимости и проводимости на ЭКГ.
Отмечаются общая слабость, анорексия, тошноста, рвота, полиурия, боли в костях. Регистрируются остеопороз, переломы костей, а также отложения солей фосфата кальция в почках и других органах, очагах некроза и хронического воспаления (тромбы, атеросклеротические бляшки), кальциноз сосудов, характерны нарушения функций почек с развитием почечной недостаточности.
Дата добавления: 2015-09-18; просмотров: 1027;
