ТЕОРИЯ РАСТВОРОВ СИЛЬНЫХ ЭЛЕКТРОЛИТОВ
Процесс электролитической диссоциации сильного электролита, в отличие от диссоциации слабого электролита, практически необратим, и его нельзя охарактеризовать константой диссоциации. Так ионы в сильных электролитах диссоциированы практически нацело, то возрастает роль межионного взаимодействия, которое количественно характеризуется его активностью a(X) и коэффициентом активности fa.
Активность иона a(X) - эффективная концентрация иона X, соответственно которой он участвует во взаимодействиях, протекающих в растворах сильных электролитов:
а(Х) =fa ∙c(Х) , (1)
где с(Х) - концентрация иона Х в растворе,
fa - коэффициент активности иона Х в растворе.
Коэффициент активности иона fa показывает, во сколько раз активность иона отличается от его истинной концентрации в растворе сильного электролита. Значение коэффициента активности иона зависит от: 1) концентрации этого иона (сначала уменьшается, а затем растет с ростом концентрации); 2) температуры (увеличивается с ростом температуры); 3) концентрации других ионов (влияет общая концентрация всех ионов в растворе).
Г. Льюис(1907)ввел понятие ионной силы раствора электролита.
Ионная сила раствора I - величина, характеризующая интенсивность электростатического поля всех ионов в растворе, которая равна полусумме произведений молярной концентрации (с) каждого иона на квадрат его заряда:
I = 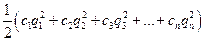 , (2)
, (2)
где q1, q2, q3, ... ,qn - заряды всех ионов, находящихся в растворе,
c1, c2, c3, ... ,cn – молярные концентрации ионов.
В очень разбавленных растворах зависимость между коэффициентом активности иона fa, зарядом этого иона q1и ионной силой I описывается уравнением Дебая — Хюккеля:
lg fa(Z1) = 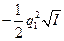 (3)
(3)
Дата добавления: 2015-09-18; просмотров: 879;
