КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ
Коллигативными свойствами растворов называются свойства, обусловленные некоторыми общими причинами. Количественное выражение этих свойств зависит только от числа находящихся в растворе частиц растворённого вещества и количества растворителя.
К коллигативным свойствам относятся:
- понижение давления пара над раствором;
- повышение точки кипения раствора;
- понижение температуры замерзания раствора;
- осмотическое давление растворов.
I закон Рауля: относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворённого вещества:
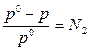 (1)
(1)
II закон Рауля: повышение t°кип и понижение t°зам разбавленных растворов неэлектролитов прямо пропорционально моляльной концентрации раствора:
Dt°кип= КЭ ∙mc (2)
Dt°зам = КК ∙ mc (3)
Измерение понижения t° начала замерзания раствора по сравнению с t° замерзания чистого растворителя называется криоскопией. Измерение повышения t° кипения раствора — эбулиоскопией.
На измерениях t°зам и t°кип растворов основаны криоскопический и эбулиоскопический методы определения относительной молекулярной массы, а также молярной массы электролитов.
Если через мембрану между двумя растворами может свободно проходить растворитель, но не может пройти растворённое вещество, выравнивание концентраций будет происходить лишь за счёт перемещения молекул растворителя. Такая односторонняя диффузия растворителя через полупроницаемую мембрану под действием разности концентраций называется осмосом. Возникающее при этом избыточное гидростатическое давление, противодействующее проникновению молекул воды в раствор, называется осмотическим давлением.
Pосм = CM · R · T (4)
У растений, некоторых морских животных и рыб осмотическое давление меняется в зависимости от внешней среды.
У высших животных и человека осмотическое давление внутренней среды постоянно и равно 7,7 атм [770-780 кПа, 280-310 мосм/л].
Изоосмию поддерживают ткани печени, подкожной клетчатки, почки. Регулируют изоосмию нервная система и железы внутренней секреции.
Понижение осмотического давления ведёт к рвоте и судорогам, повышение — вызывает отёки.
Растворы, имеющие одинаковое осмотическое давление, называются изотоническими; более высокое осмотическое давление — гипертоническими; более низкое — гипотоническими растворами.
0,9% раствор NaCl, 5% раствор глюкозы относительно крови являются изотоническими.
При помещении клеток в изотонический раствор клетки сохраняют свой размер и нормально функционируют.
При помещении клеток в гипертонический раствор вода из клеток уходит в более концентрированный раствор, клетка теряет воду, уменьшается в объёме, в ней нарушается нормальное течение физических и химических процессов — происходит плазмолиз.
При помещении клеток в гипотонический раствор вода из менее концентрированного раствора переходит внутрь клеток. Это приводит к их набуханию, а затем к разрыву оболочек и вытеканию клеточного содержимого. Это лизис.
В случае эритроцитов этот процесс называется гемолизом. При этом образуется «лаковая кровь» — раствор ярко-красного цвета, окрашенный гемоглобином.
Чтобы использовать законы идеальных растворов для количественного описания коллигативных свойств электролитов, Вант-Гофф ввёл в соответствующие уравнения поправочный коэффициент i — изотонический коэффициент Вант-Гоффа.
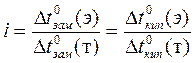 (5)
(5)
Для растворов элекролитов i > 1, для растворов неэлектролитов i = 1.
Дата добавления: 2015-09-18; просмотров: 1209;
