Выберите один правильный ответ. 1. Что изучает химическая кинетика?
1. Что изучает химическая кинетика?
1) Изучает возможность и направление химических реакций.
2) Изучает скорость и механизм химических реакций, и зависимость их от различных факторов.
3) Тепловой эффект химической реакции.
4) Изменение энтропии и энтальпии химических реакций от времени.
2. Для какой из реакций записано кинетическое уравнение скорости реакции v = k×C2A×CB:
1) А2(г) + В(г) ® С(г) 2) 2А(г) + В(тв) ® С(г)
3) А2(тв) + В(г) ® С(г) 4) 2А(г) + В(г) ® С(г)
3. Как изменится скорость реакции при повышении температуры на 20°, если температурный коэффициент скорости реакции равен 3?
1) Увеличится в 3 раза. 2) Увеличится в 6 раз.
3) Увеличится в 9 раз. 4) Увеличится в 60 раз.
4. Что такое молекулярность химической реакции?
1) Обще число молекул в единице объема.
2) Число молекул продуктов реакции.
3) Общее число молекул исходных веществ и продуктов реакции.
4) Число молекул, участвующих в элементарном акте реакции.
5. Для какой реакции справедливо утверждение, что скорость реакции – это изменение концентрации вещества в единицу времени:
1) Для любой реакции. 2) Для гетерогенной реакции.
3)Для обратимой реакции. 4) Для гомогенной реакции.
6. В чем заключается сущность действия катализатора?
1) Катализатор повышает энергию активации реакции.
2) Катализатор с реагирующими веществами образует неустойчивые промежуточные соединения, при этом энергия активации понижается.
3) Катализатор уменьшает долю активных частиц в реакционной смеси.
4) Катализатор смещает химическое равновесие и увеличивает выход продукта обратимой реакции.
7. Укажите единицы измерения скорости гетерогенной реакции
1) моль/(м2×с). 2) моль/(л×с). 3) л/(с×моль). 4) л2/(с×моль2).
8. Каков физический смысл константы скорости реакции?
1) Константа скорости реакции есть скорость реакции при постоянных концентрациях реагирующих веществ.
2) Характеризует зависимость скорости реакции от температуры.
3) Константа скорости есть скорость реакции при концентрации реагирующих веществ, равных единице.
4) Характеризует состояние химического равновесия.
9. Константа химического равновесия для реакции 2NO + O2 « 2NO2 имеет вид:
1)  . 2)
. 2)  .
.
3)  . 4)
. 4) 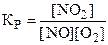 .
.
10. Система, в которой повышение давления и повышение температуры приведут к смещению равновесия в противоположных направлениях:
1) СО2(г) + С(т) « 2СО2(г) + Q. 2) I2(г) + 5CO2(г) « I2O5(т) + 5CO(г) – Q.
3) N2(г) + O2(г) « 2NO(г) – Q. 4) C2H2(г) + 2H2(г) « C2H6(г) + Q.
Дата добавления: 2015-09-18; просмотров: 1277;
