Примеры решения задач. Пример 1. Написать уравнения электрохимических процессов, происходящих на аноде (анод инертный) и катоде при электролизе раствора бромида меди (II).
Пример 1. Написать уравнения электрохимических процессов, происходящих на аноде (анод инертный) и катоде при электролизе раствора бромида меди (II).
Решение. В водном растворе CuBr2 диссоциирует следующим образом:
CuBr2 ←→ Cu2+ + 2Br –.
Стандартный электродный потенциал водородного электрода в нейтральной водной среде:
2H2O + 2ē → H2↑ + 2OH– (–0,41В).
Это значительно отрицательнее потенциала системы:
Cu2+ + 2e → Cu0 (+0,34В).
Поэтому на катоде будет происходить электрохимическое осаждение меди:
Cu2+ + 2ē → Cu0.
На аноде будет происходить окисление ионов брома, приводящее к выделению газообразного брома:
Br – – ē → Br0 ;
2Br0 → Br2↑;
поскольку электрохимическое окисление воды:
2H2O – 4e → O2↑ + 4H+
из нейтральных сред может протекать при потенциалах не менее (+1,23 В), что выше стандартного электродного потенциала, характеризующего выделение газообразного брома (+1,07 В).
Пример 2. Написать уравнения электрохимических процессов, происходящих на аноде и катоде при электролизе раствора сульфата натрия (анод инертный).
Решение. В водном растворе Na2SO4 диссоциирует следующим образом:
Na2SO4 ←→ 2Na+ + SO42–.
Стандартный электродный потенциал системы:
Na+ + ē → Na0 (–2,71 В)
значительно отрицательнее потенциала водородного электрода в нейтральной среде (–0,41 В). Поэтому на катоде будет происходить электрохимическое разложение воды с выделением водорода:
2H2O + 2ē → H2↑ + 2OH–,
а ионы натрия, приходящие к катоду, будут накапливаться в прилегающей к нему части раствора (катодное пространство).
На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода:
2H2O – 4e → O2↑ + 4H+,
поскольку отвечающей этой системе стандартный электродный потенциал (+1,23 В) значительно ниже, чем стандартный электродный потенциал (+2,01 В), характеризующий систему:
2SO42– – 2ē → S2O82–.
Сульфат-ионы, движущиеся при электролизе к аноду, будут накапливаться в анодном пространстве.
Пример 3. Написать уравнения электрохимических процессов, происходящих на катоде и аноде при электролизе раствора сульфата цинка с цинковым анодом.
Решение. В водном растворе ZnSO4 диссоциирует следующим образом:
ZnSO4 ←→ Zn2+ + SO42–.
Стандартный электродный потенциал системы:
Zn2+ + 2ē → Zn0 (–0,76 В)
близок к потенциалу водородного электрода в нейтральной водной среде (– 0,41 В), поэтому на катоде будут совместно протекать два процесса восстановления:
Zn2+ + 2ē → Zn0;
2H2O + 2ē → H2↑ + 2OH–.
На аноде возможно протекание трех окислительных процессов: электрохимического окисления воды, приводящего к выделению кислорода (+1,23 В), окисления сульфат-ионов (+2,01 В) и окисления материала анода, т.е. цинка (–0,76 В). Сравнение электродных потенциалов систем позволяет сделать вывод об окислении анода и выделении ионов цинка в раствор:
Zn0 – 2ē → Zn2+.
Пример 4. Определить массу цинка, которая выделится на катоде при электролизе сульфата цинка в течение одного часа при токе 26,8 А, если выход по току цинка равен 50 %.
Решение. Расчет ведем согласно объединенному уравнению из законов Фарадея (4). Масса моля эквивалента (химический эквивалент вещества) цинка в ZnSO4 равна (65,38 / 2) = 32,69 г/моль экв. Не забыв выразить время в секундах, подставим в уравнение закона Фарадея все известные значения и определим массу цинка, которая должна выделиться (при условии, если весь ток будет израсходован на выделение цинка):
m = (32,69 ∙ 26,8 ∙ 3600) / 96485 = 32,69 г.
Так как выход по току цинка составляет 50%, то практически на катоде выделится цинка:
mпр = 32,69 ∙ (50/100) = 16,345 г.
Пример 5. Рассчитать ток при электролизе раствора в течение 1 ч 40 мин 25 с, если на катоде выделилось 1,4 л водорода, измеренного при нормальных условиях.
Решение. Из формулы (4) выразим силу тока:
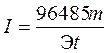 .
.
Так как количество водорода дано в единицах объема, то отношение m/Э заменяем отношением VH2/Vэкв H2 , где VH2— объем водорода, л; Vэкв H2— объем одного моля эквивалента водорода.
Объем моля эквивалента водорода при нормальных условиях равен половине моля молекул водорода Vэкв H2= 22,4/2 = 11,2 л, так как моль любого газа в нормальных условиях занимает объем, равный 22,4 л, а в процессе электрохимического восстановления водорода участвуют два электрона. Подставив в приведенную формулу числовые значения, получим:
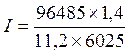 = 2 А.
= 2 А.
Дата добавления: 2015-09-14; просмотров: 1726;
