Законы Фарадея (законы электролиза)
Связь между количеством выделившегося при электролизе веществ и количеством электричества, прошедшего через электролит, выражается двумя законами Фарадея.
Первый закон Фарадея. Масса вещества, выделившегося на электроде при электролизе, прямо пропорциональна количеству электричества, прошедшего через электролит:
m = kQ,
где m — масса вещества, г; k – электрохимический эквивалент, т.е. масса вещества, выделившаяся при прохождении одного кулона электричества, г/Кл; Q – количество электричества, Кл (Q = It, где I — сила тока, t — время, с).
Второй закон Фарадея. Одинаковое количество электричества выделяет при электролизе на электродах эквивалентные массы различных веществ. Для выделения одного моля эквивалента любого вещества необходимо затратить одно и то же количество электричества, а именно 96485 Кл, называемое числом Фарадея.
Тогда электрохимический эквивалент:
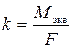 ,
,
где Mэкв — молярная масса химического эквивалента вещества (иона)*, г/моль экв.
Из первого и второго законов Фарадея вытекает объединенное уравнение:
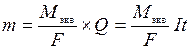 ;
;
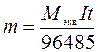 . (4)
. (4)
Дата добавления: 2015-09-14; просмотров: 859;
