ТЕОРЕТИЧЕСКАЯ ЧАСТЬ. 1.1. Электроотрицательность элементов и образование химической связи
1.1. Электроотрицательность элементов и образование
химической связи
Известно, что атомы объединяются в молекулы за счет образования между ними химической связи, которая возникает в результате перераспределения электронов между атомами. Существует несколько видов химической связи: ковалентная неполярная, ковалентная полярная, ионная, металлическая, но во всех случаях характеристики связи и то, какой вид связи образуется, зависит от такого свойства участвующих в ней атомов, как электроотрицательность. Эта характеристика позволяет судить, насколько легко атом отдает свои электроны и насколько активно принимает на вакантные места своей электронной оболочки электроны других атомов. Часто электроотрицательность определяют как относительную способность атомов элемента оттягивать на себя общую электронную пару, образующую химическую связь. Сравнивая электроотрицательности взаимодействующих атомов, можно определить, какой из них будет присоединять электрон (в случае ионной связи) или оттягивать на себя электронную пару (в случае полярной ковалентной связи), а какой будет отдавать электрон, полностью или частично.
По одному из методов для количественной оценки электроотрицательностей вычисляют среднее арифметическое величин энергии ионизации и сродства к электрону.
Энергия ионизации — энергия, необходимая для отрыва электрона от атома с превращением его в положительный ион. Она тем меньше, чем меньше число электронов на последнем энергетическом уровне и чем больше радиус атома.
Сродство́ атома к электрону — энергия, выделяющаяся при присоединении электрона к свободному атому. Сродство металлов к электрону, как правил, близко к нулю или отрицательно. Для неметаллов это величина всегда положительная и тем больше, чем ближе к инертному газу расположен неметалл в Периодической таблице, т.е. чем более заполнен последний энергетический
уровень. Самым высоким сродством к электрону характеризуются галогены.
Для удобства используют не абсолютные значения электроотрицательности, а относительные, т.е. отнесенные к электроотрицательности лития, для которого относительная электроотрицательность принята равной единице.
В соответствии с изменением радиусов атомов и числа электронов на последнем энергетическом уровне, электроотрицательность элементов в Периодической таблице (см. рис. 1) возрастает в направлении слева направо для элементов каждого периода и уменьшается в направлении сверху вниз для элементов подгруппы одной и той же группы Периодической таблицы. Элементы главных и побочных подгрупп рассматриваются раздельно, так как строение их электронных оболочек значительно отличается. Для этого как раз удобен использованный длиннопериодный вариант Периодической таблицы Д.И. Менделеева, в котором вставные декады элементов побочных подгрупп служат переходом между элементами главных подгрупп того же периода.
Важнейшие химические элементы представляют в виде ряда электроотрицательности:
| K | Na | Li | Mg | H | S | C | I | Br | Cl | N | O | F |
| 0,8 | 0,9 | 1,0 | 1,2 | 2,1 | 2,5 | 2,5 | 2,5 | 2,8 | 2.9 | 3,0 | 3,5 | 4,0 |
Сравним два типа химической связи: ионную и ковалентную полярную. Принято считать, что образование ионной связи сопровождается полным переносом электронов от одних атомов к другим, вследствие чего образуются разноименно заряженные частицы (катионы и анионы), которые притягиваются друг к другу, образуя молекулы. Например, ионы Na+ и Cl– соединяются в молекулу NaCl. Также принято считать, что при ионной связи электрические заряды каждого из атомов противоположны по знаку и равны целому числу: единице, как в данном случае, двум, трем и т.д.
При образовании ковалентной полярной связи происходит не отдача, а только смещение связующих электронов в сторону более
| H 2,1 | ||||||||||||||||
| Li 1,0 | Be 1,5 | B 2,0 | C 2,5 | N 3,0 | O 3,5 | F 4,0 | ||||||||||
| Na 0,9 | Mg 1,2 | Al 1,5 | Si 1,8 | P 2,1 | S 2,5 | Cl 2,9 | ||||||||||
| K 0,8 | Ca 1,0 | Sc 1,3 | Ti 1,5 | V 1,6 | Cr 1,6 | Mn 1,5 | Fe 1,8 | Co 1,8 | Ni 1,8 | Cu 1,9 | Zn 1,6 | Ga 1,6 | Ge 1,8 | As 2,0 | Se 2,4 | Br 2,8 |
| Rb 0,8 | Sr 1,0 | Y 1,2 | Zr 1,4 | Nb 1,6 | Mo 1,8 | Tc 1,9 | Ru 2,2 | Rh 2,2 | Pd 2,2 | Ag 1,9 | Cd 1,7 | In 1,7 | Sn 1,8 | Sb 1,9 | Te 2,1 | I 2,5 |
| Cs 0,7 | Ba 0,9 | La 1,1 | Hf 1,3 | Ta 1,5 | W 1,7 | Re 1,9 | Os 2,2 | Ir 2,2 | Pt 2,2 | Au 2,4 | Hg 1,9 | Tl 1,8 | Pb 1,8 | Bi 1,9 | Po 2,0 | At 2,2 |
| Fr 0,7 | Ra 0,8 | Ac 1,1 | ||||||||||||||
| Рис. 1. Относительные электроотрицательности химических элементов |
электроотрицательного атома. Например, электронно-графическая формула бромистого водорода HBr:
..
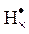 Br:
Br:
..
Электрон водорода, участвующий в образовании связи, показан знаком "×". В молекуле HВr более электроотрицательный атом брома оттягивает к себе электронную пару. Поэтому атом водорода несет на себе некоторый избыточный положительный заряд, а атом брома — такой же по абсолютному значению избыточный отрицательный заряд. На самом деле эти заряды значительно меньше, чем (+1) или (–1), но, для упрощения, при подсчете электронов, принадлежащих каждому из атомов, полностью приписывают связующую пару электронов более электроотрицательному атому брома. Такое допущение означает, что у брома стало восемь электронов, а водород лишен электрона, т.е. брому условно приписывают заряд (–1), а водороду (+1). Таким образом, для молекул с ковалентным типом связи условно считают, что электронные пары, связывающие данный атом с другим атомом, так же как и при образовании ионной связи, полностью переданы более электроотрицательному атому. Отсюда следует определение степени окисления:
Степень окисления — условный электрический заряд, который приписывается атому в составе молекулы при допущении, что молекула построена по ионному типу.
Степени окисления атомов принято проставлять над символами атомов в соединении с указанием знака впереди числа:
+1 –1 +1 +4 –2 +1+5–2 +1 –2
HCl, H2SO3, HNO3, H2O2.
В качестве другого примера рассмотрим распределение электронов в молекуле пероксида водорода H2O2 (по ранее применявшейся номенклатуре перекись водорода). Его электронно-графическая формула:
.. ..
H: O : O : H
·· ··
В этом соединении оба атома кислорода имеют степень окисления, равную (–1), так как общая электронная пара двух атомов кислорода принадлежит им в равной степени. Эта связь — ковалентная неполярная. Перетягиваются только электронные пары, образующие связи с атомами водорода. Степень окисления атомов водорода в этом соединении, как и в молекуле воды, равна (+1).
Радикал [O2]2– может или отдатьдва электрона, или столько же присоединить. В зависимости от этого перекись водорода выполняет функции либо восстановителя, либо окислителя. Такое свойство называется окислительно-восстановительной двойственностью, подробнее об этом в разделе 1.4.
Дата добавления: 2015-09-14; просмотров: 2143;
