Структурная организация ферментов
Ферменты – это глобулярные белки, состоящие из одной или нескольких полипептидных цепей, организованных в 3-х мерную структуру.
По химическому строению различают простые (однокомпонентные) ферменты (состоят только из аминокислот) и сложные двукомпонентные ферменты (имеющие небелковую часть - кофактор).
Кофакторы – это вещества, способствующие действию ферментов, или необходимые для его осуществления. Роль кофактора в основном сводится к следующему:
· изменение третичной структуры белка и создание комплементарности между ферментом и субстратом, стабилизация молекулы фермента в пространстве;
· непосредственное участие в реакции в качестве еще одного субстрата.
Кофакторы делят, хотя и достаточно условно, на коферменты и простетические группы.
Добавочную группу, прочно связанную, не отделяемую от белковой части, называют простетической группой; в отличие от этого добавочную группу, легко отделяющуюся от апофермента и способную к самостоятельному существованию, обычно именуют коферментом.
Химическая природа важнейших коферментов была выяснена в 30-е годы нашего столетия благодаря трудам О. Варбурга, Р. Куна, П. Каррера и др. Оказалось, что роль коферментов в двухкомпонентных ферментах играют большинство витаминов (Е, К, Q, В1, В2, В6 В12, Н и др.) или соединений, построенных с участием витаминов (коэнзим А, НАД+ и т. п.). Кроме того, функцию коферментов выполняют такие соединения, как НS-глутатион, многочисленная группа нуклеотидов и их производных, производные некоторых моносахаридов, ряд других веществ.
Характерной особенностью двухкомпонентных ферментов является то, что ни белковая часть, ни добавочная группа в отдельности не обладают заметной каталитической активностью. Только их комплекс проявляет ферментативные свойства. При этом белок резко повышает каталитическую активность добавочной группы, присущую ей в свободном состоянии в очень малой степени; добавочная же группа стабилизирует белковую часть и делает ее менее уязвимой к денатурирующим агентам.
В апоферменте есть участок, характеризующийся специфической структурой, избирательно связывающий кофермент. Это так называемый кофермент связывающий домен; его структура у различных апоферментов, соединяющихся с одним и тем же коферментом, очень сходна.
Каждый кофермент имеет определенную структуру, что делает его специфичнымдля определенного типа реакций (табл.1).
В процессе катализа реакции в контакт с субстратом вступает не вся молекула фермента, а определенный ее участок, который называется активным центром. Эта зона молекулы не состоит из последовательности аминокислот, а формируется при формировании третичной структуры белковой молекулы.
Активный центр — это относительно небольшой участок, расположенный в узком гидрофобном углублении (щели) поверхности молекулы фермента, непосредственно участвующий в связывании, удержании субстрата и катализе.
В активном центре различают две зоны: центр связывания (или субстратсвязывающий участок), ответственный за присоединение и удержание субстрата, и каталитический центр, отвечающий за химическое превращение субстрата (рис. 1). Необходимо понимать, что в реальных ферментах субстратный центр может совпадать (или перекрываться) с каталитическим центром. Более того, каталитический центр может окончательно формироваться в момент присоединения субстрата. Поэтому часто говорят об активном центре фермента, представляющем сочетание первого и второго.
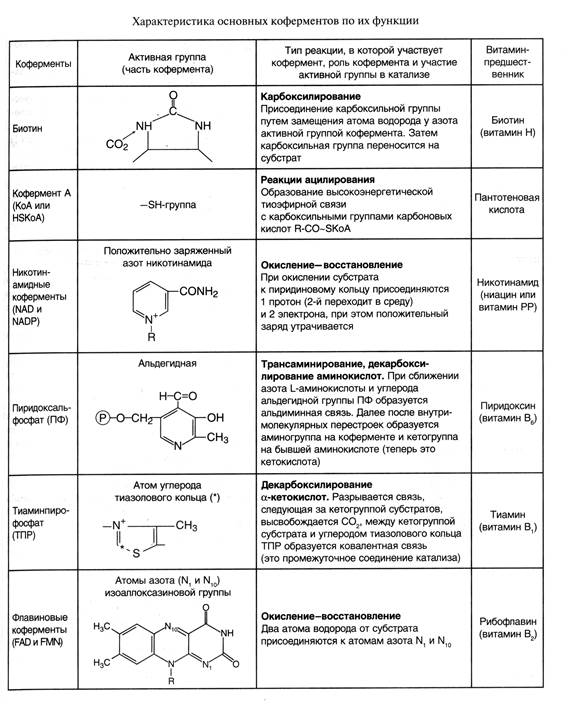
Таблица 1
Как уже указывалось, сложные ферменты в каталитическом центре имеют участок или домен для связывания кофактора.
Помимо активного центра ряд ферментов снабжен регуляторным центром. С этой зоной фермента взаимодействуют эффекторы, влияющие на его каталитическую активность.
Ферментативные эффекторы - вещества, изменяющие скорость ферментативного катализа. Среди них различают ингибиторы - замедляющие скорость реакции и активаторы - ускоряющие ферментативную реакцию.
2. СПЕЦИФИЧНОСТЬ ФЕРМЕНТОВ
Различают два главных вида специфичности ферментов: СУБСТРАТНУЮ СПЕЦИФИЧНОСТЬ и СПЕЦИФИЧНОСТЬ ДЕЙСТВИЯ.
Специфичность действия- это способность фермента катализировать только определенный тип химической реакции.
Субстратная специфичность - это способность фермента катализировать превращения только одного определенного субстрата или же группы сходных по строению субстратов. Определяется структурой адсорбционного участка активного центра фермента. Большинство ферментов высокоспецифично как к природе, так и к пути превращения субстрата. Специфичность к субстрату обусловлена комплементарностью структуры субстратсвязывающего центра фермента структуре субстрата.
Как показывает рис. 2, субстратсвязывающий участокпо форме соответствует субстрату (геометрическое соответствие), более того, между аминокислотными остатками активного центра фермента и субстратом образуются специфические связи (гидрофобные, ионные и водородные), т.е. устанавливаетсяэлектронное илихимическое соответствие.
Связывание субстрата с активным центром фермента происходитмноготочечно, с участием нескольких функциональных групп, которые далее могут участвовать в катализе.
Ферменты могут различаться по субстратной специфичности и обладатьабсолютной специфичностью, т.е. действовать только на один субстрат и не взаимодействовать даже с очень близкими по строению молекулами (например, уреаза ускоряет гидролиз мочевины, но не действует на тиомочевину), или дажестереоспецифичностыо (когда фермент взаимодействует с определенным оптическим и геометрическим изомером).
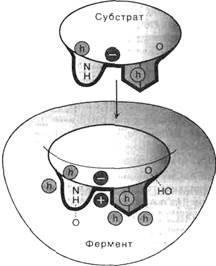
Рис. 2. Геометрическое и химическое соответствие (комплементарность) между ферментом и субстратом. h - гидрофобные группы, ¼¼¼ - водородные связи.
Некоторые ферменты проявляют более широкую специфичность(групповая илиотносительная специфичность) и взаимодействуют со многими веществами, имеющими похожую структуру (протеазы ускоряют гидролиз пептидных связей в белках, липазы ускоряют расщепление эфирных связей в липидах
Пример. Сериновые протеазы проявляют групповую специфичность к субстратам. Все они ускоряют гидролиз пептидных связей в белках, но, имея похожую структуру и каталитический механизм, различаются по субстратной специфичности.

| 
| 
|
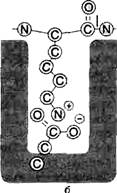
| В химотрипсине субстрат-связывающий участок представляет гидрофобный карман, который связывает радикалы ароматических аминокислот, таких, как фенилаланин. Этот фермент ускоряет гидролиз пептидных связей, образованных карбоксильной группой ароматических аминокислот. | В трипсине отрицательный заряд остатка аспарагиновой кислоты в активном центре участвует как в связывании аминогруппы лизина (или гуанидиновой группы аргинина), так и непосредственно в катализе, при котором разрывается пептидная связь, в образовании которой участвует карбоксильная группа положительно заряженных остатков Лиз и Apr. | В эластазе остатки валина и треонина, входящие в состав субстратсвязывающего центра, допускают связывание остатков аминокислот только с небольшими боковыми цепями, например, как у глицина. |
Рис. 3. Характеристика субстратсвязывающих центров сериновых протеаз. Стрелки — разрываемые связи в полипептидных цепях белков—субстратов. а — гидрофобный карман; б — ионная связь; в — небольшой гидрофобный карман.
Сравнительно недавно выявлена еще одна своеобразная черта в строении однокомпонентных ферментов: некоторые из них являются полифункциональными, т.е. обладают несколькими энзиматическими активностями, но всего лишь одной полипептидной цепью. Эта единая цепь при формировании третичной структуры образует несколько функционально и пространственно обособленных глобулярных участков - доменов, каждый из которых характеризуется своей каталитической активностью.
Дата добавления: 2015-09-14; просмотров: 1579;
