МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ
По образному выражению, нередко употребляемому в биохимической литературе,фермент подходит к субстрату, как ключ к замку. Это знаменитое правило было сформулировано Э. Фишером в 1894 г. исходя из того, что специфичность действия фермента предопределяется строгим соответствием геометрической структуры субстрата и активного центра фермента.
В 50-е годы нашего столетия это статическое представление было заменено гипотезой Д. Кошланда об индуцированном соответствии субстрата и фермента. Сущность ее сводится к тому, что пространственное соответствие структуры субстрата и активного центра фермента создается в момент их взаимодействия друг с другом, что может быть выражено формулой “перчатка - рука”. При этом в субстрате уже деформируются некоторые валентные связи и он, таким образом, подготавливается к дальнейшему каталитическому видоизменению, а в молекуле фермента происходят конформационные перестройки.
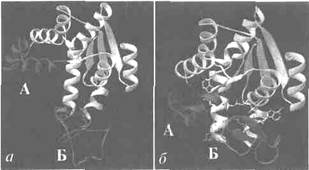
| Обратите внимание надоменыАи Б. Домены А и Б участвуют в связывании субстратов и препятствуют проникновению воды (которая бы способствовала гидролизу нуклеотидов, а не переносу фосфатных групп). Связывание субстрата запускает конформационные изменения, которые видны на рис. б. Обратите внимание, что домены сблизились и их конформация изменилась. Домен Б приобрел более упорядоченную вторичную структуру, в нем появились b-складчатые элементы. На рис. б видно, что оба домена прикрывают субстрат. |
Рис. 5 Конформационные изменения в аденилаткиназе при связывании синтетического аналога субстратов. а — пространственная структура аденилаткиназы; б— аденилатциклаза, связанная с синтетическим аналогом субстратов.
В настоящее время гипотеза Кошланда получила дальнейшее развитие в гипотезу топохимического соответствия. Сохраняя основные положения гипотезы взаимоиндуцированной настройки субстрата и фермента, она фиксирует внимание на том, что специфичность действия ферментов объясняется в первую очередь узнаванием той части субстрата, которая не изменяется при катализе. Между этой частью субстрата и субстратным центром фермента возникают многочисленные точечные гидрофобные взаимодействия и водородные связи.
Дата добавления: 2015-09-14; просмотров: 653;
