Магнитное квантовое число
Ориентация электронного облака в пространстве также не может быть произвольной: она определяется значением магнитного квантового числа(ml).
Магнитное квантовое число (ml) может принимать любые целочисленные значения в интервале от -l до +l, и рассчитывается по формуле:
ml = 2l + 1
| число значений, l | число значений, ml | Ориентация электр.облака | Колич. орбиталей |
| для s-электронов, l = 0, | ml = 0 | сфера | |
| р-электронов, l = 1, | ml = -1; 0; 1 | по оси Х,Y и Z | |
| d-электронов, l = 2, | ml = -2;-1; 0; 1; 2 | разные ориентации в пространстве | |
| f-электронов, l = 3, | ml = -3; -2-1; 0; 1; 2; 3 | –«– |
Электроны,имеющие одинаковые значенияп, l и ml,находятся на одной орбитали.
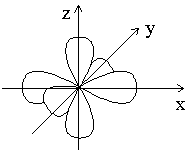
Например, три p-электронных облака с ml = -1; 0; +1 располагаются в пространстве перпендикулярно друг другу, как показано на рисунке
Спиновое квантовое число (тs)
Исследование атомных спектров показало, что помимо квантовых чисел n, l, ml, электрон характеризуется ещё одной квантованной величиной, не связанной с движением электрона вокруг ядра, а определяющей его собственное движение. Эта величина получила название спинового квантового числа (ms).
У электрона спиновое квантовое число может принимать два значения: ms = +1/2 и ms = -1/2 . Схематическое изображение:
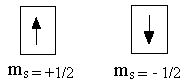
Согласно принципа Паулив атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковы.
Из этого следует, что на каждой атомной орбитали, характеризующейся определёнными значениями n, l, ml , может находиться не более двух электронов, причём спины этих электронов должны быть противоположно направлены (так как только в этом случае спиновые квантовые числа электронов будут отличаться: у одного электрона ms = +1/2, у другого ms = -1/2).
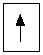 Обозначение неспаренного электрона на атомной орбитали:
Обозначение неспаренного электрона на атомной орбитали:
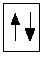 Обозначение двух спаренных электронов с противоположными спинами, находящихся на одной атомной орбитали:
Обозначение двух спаренных электронов с противоположными спинами, находящихся на одной атомной орбитали:
Итак, четыре квантовых числаn, l, ml, msоднозначно определяют состояние электрона в атоме.
Дата добавления: 2015-09-11; просмотров: 3325;
