V(D)J-рекомбінація імуноглобулінових генів
Основою імунної відповіді при появі чужорідної молекули чи частинки – антигену – є синтез імуноглобуліну певного типу, який має до цього антигену високу специфічну спорідненість. Кількість типів імуноглобулінів, як і антигенів, є практично необмеженою. Зрозуміло, що закодувати таке розмаїття у вигляді окремих імуноглобулінових генів також неможливо. Еволюційним розв’язанням цієї проблеми став особливий рекомбінаційний процес дозрівання імуноглобулінових генів.
Молекула імуноглобуліну складається з двох так званих важких і двох легких поліпептидних ланцюгів (рис. 10). Кожен із ланцюгів має константну С-кінцеву (спільну для усіх імуноглобулінів) і варіабельну N-кінцеву частини. Варіабельні частини кожної пари важкого та легкого ланцюгів формують два антиген-зв’язувальні сайти на поверхні молекули.
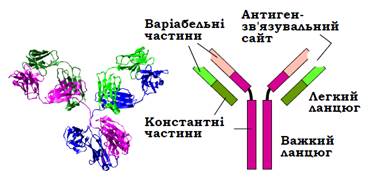
Рис. 10. Структура імуноглобуліну IgG1 (1IGY) і схема будови молекули.
Незрілі імуноглобулінові гени мають вигляд кластерів окремих елементів нуклеотидної послідовності – блоків, з яких шляхом рекомбінації в імунокомпетентній клітині збирається активний імуноглобуліновий ген. Кластер важкого ланцюга містить ~100 V-сегментів (від variable), що тандемно повторюються (послідовності всіх сегментів розрізняються між собою), ~30 D-сегментів (від diversity), шість J-сегментів (від joining) і С-ділянку, яка кодує константну частину ланцюга (рис. 11). Аналогічно побудований кластер легкого ланцюга, який містить тільки два типи варіабельних сегментів (~100 V- та чотири J-сегменти). Активний ген «збирається» із сегментів трьох (або двох) типів, як із кубиків, шляхом V(D)J-рекомбінації: один випадковий D-сегмент з’єднується з випадковим J-сегментом (ділянка між ними вирізається), до них приєднується один з V-сегментів (рис. 11). Аналогічно, для легкого ланцюга об’єднуються один V- з одним із J-сегментів. Перед кожним V-сегментом розташований промотор, у спейсері перед С-ділянкою – енхансер. Їхнє зближення після рекомбінації активує транскрипцію, зайві спейсери та інтрони константної частини видаляються з мРНК шляхом сплайсингу.

Рис. 11. Будова кластера генів важкого ланцюга імуноглобуліну та схема збирання активного гена. Константна частина (С) містить інтрони, які не показано.
Для важкого ланцюга може реалізуватися ~ 18 тис. комбінацій між сегментами трьох типів, для легкого – ~ 400 комбінацій, і загалом за рахунок рекомбінації для обох ланцюгів утворюється ~7 млн варіантів послідовності. Додаткова варіабельність забезпечується за рахунок індукції мутацій у межах V-сегментів, а також завдяки застосування механізмів незаконної рекомбінації при з’єднанні сегментів.
Рекомбінація сегментів залежить від сигнальних послідовностей RSS (Recombination Signal Sequence), що фланкують із двох боків кожен із сегментів (рис. 12) і є сайтами рекомбінації. Сигнальні послідовності містять дві консервативні ділянки по сім та дев’ять пар основ, розділені неконсервативним спейсером. Послідовність спейсера не має значення – важливий лише його розмір: два типи спейсерів довжиною 23 і 12 пар основ визначають два типи RSS. Об’єднання сегментів при рекомбінації можливе лише за умови виконання правила «12/23»: об’єднуються тільки сегменти, фланковані RSS різних типів. Завдяки цьому виключається об’єднання однотипних сегментів (наприклад, VV) чи пропущення D-сегмента.
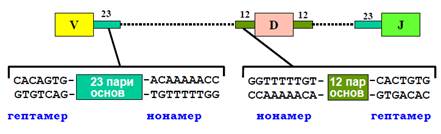
Рис. 12. Організація сигнальних послідовностей,які контролюють рекомбінацію в імуноглобулінових генах.
Консервативні елементи сигнальних послідовностей упізнаються білками RAG 1 та RAG 2 (продукти генів RAG – Recombination Activating Gene, активних лише у клітинах попередниках В і Тлімфоцитів). Білки об’єднують у єдиний комплекс дві сигнальні послідовності при виконанні умови «12/23» і каталізують низку реакцій, яку схематично показано на рис. 13. Перша реакція – одноланцюговий розріз між сегментом і сигнальним гептамером. Далі відбувається транс-естерифікація – розрив зв’язку в іншому ланцюзі та ковалентне замикання кінців сегмента у шпильку. Унаслідок таких самих реакцій у другій RSS вирізається, замикається в кільце та видаляється ділянка між двома сегментами.
Ковалентні шпильки на кінцях сегментів є нестабільними – вони швидко розмикаються (рис. 13). При цьому необов’язково утворюється тупий (без одноланцюгових виростів) кінець, оскільки шпилька може розімкнутися асиметрично. На останніх стадіях 3′-кінці сегментів добудовуються дезоксирибонуклеотидилтрансферазою (рис. 14) – ферментом, який без участі матриці приєднує випадкові нуклеотиди. Зрозуміло, що цей процес ще значно підвищує розмаїття послідовностей зрілих генів імуноглобулінів. Частина цих генів буде неактивною завдяки стоп-кодонам, що з певною імовірністю виникають при такому випадковому синтезі, проте це є прийнятною платою за загальне збільшення варіантів.
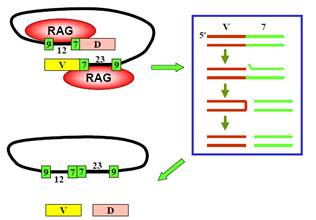
Рис. 13. Залежне від білків RAG вирізання ділянки між двома сегментами імуноглобулінового гена.

Рис. 14. Завершальні стадії процесу з’єднання сегментів імуноглобулінового гена.
Нарешті кінці сегментів з’єднуються за допомогою системи репарації дволанцюгових розривів NHEJ: відбувається пошук мікрогомології між двома 3′-кінцевими виростами та репаративний синтез ДНК, що остаточно заповнює прогалини. Таким чином, на останніх стадіях рекомбінації процес з’єднання сегментів імуноглобулінових генів навмисно «загрубляється» з метою підвищення варіабельності.
Дата добавления: 2015-09-11; просмотров: 1323;
