Структура ПС.
Періоди – горизонтальні ряди елементів, розміщених у порядку поступового зростання зарядів атомних ядер.
У межах періодів властивості елементів змінюються від типових металів до типових неметалів. Закінчується кожний період інертним газом.
Усі періоди, за винятком І (2 елементи), парні, тобто поарно вміщують однакове число елементів.
ІІ та ІІІ – 8 елементів;
ІV та V – 18 елементів;
VI – 32 елемента;
VII – не закінчений.
Періоди розміщені один під одним так, що хімічні елементи з подібними властивостями виявляються згрупованими.
Групи – вертикальні ряди елементів. Групи містять підгрупи: головну (А) та побічну (В).
До головної підгрупи входять елементи, розміщені під елементами ІІ та ІІІ періодів (типових елементів).
Елементи, зміщені відносно елементів головної підгрупи, становлять побічну підгрупу.
Побічна підгрупа VIII групи складається з трьох елементів – тріад.
Ускладненою є побічна підгрупа ІІІ групи VI та VII періодів. Її винесено під таблицю. Ці елементи – лантаноїди та актиноїди.
У межах елементів, які складають період, відбувається поступова забудова електронами зовнішнього, а часто і передостаннього підрівнів. Підрівні, що заповнюються, називають валентними. Електрони та орбіталі цих підрівнів беруть участь в утворенні хімічних зв’язків. Число таких електронів збільшується на одиницю в разі переходу від попереднього елемента до наступного, отже змінюється хімічна поведінка атомів елементів.
Номер періоду, в якому знаходиться елемент, збігається з найбільшим значенням головного квантового числа.
Кожен період починається забудовою 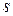 - підрівня, а закінчується формуванням
- підрівня, а закінчується формуванням 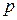 – підрівня. В IV періоді з’являється
– підрівня. В IV періоді з’являється 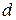 - підрівень, в VI та VII періодах -
- підрівень, в VI та VII періодах - 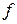 підрівень.
підрівень.
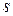 – елементів (у яких забудовується
– елементів (у яких забудовується 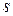 – підрівень) у кожному періоді по 2. Вони утворюють головні підгрупи 1 та 2 груп.
– підрівень) у кожному періоді по 2. Вони утворюють головні підгрупи 1 та 2 груп.

Ці елементи – типові метали (крім Н, Не).
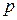 – елементів (у яких
– елементів (у яких 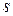 – підрівень вже сформований і поступово забудовується
– підрівень вже сформований і поступово забудовується 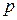 – підрівень) у кожному періоді по 6. Вони утворюють головні підгрупи 3 - 8 груп.
– підрівень) у кожному періоді по 6. Вони утворюють головні підгрупи 3 - 8 груп.
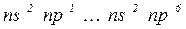
Властивості цих елементів змінюються від металічних до типово неметалічних.
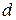 - елементів (у атомах яких заповнюється
- елементів (у атомах яких заповнюється 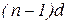 – підрівень) – по 10. Вони утворюють побічні підгрупи елементів усіх груп.
– підрівень) – по 10. Вони утворюють побічні підгрупи елементів усіх груп.
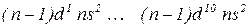
Всі вони є металами (наз. перехідні метали).
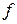 - елементів (у атомах яких заповнюється
- елементів (у атомах яких заповнюється 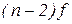 – підрівень) – по 14. Вони утворюють побічні підгрупи ІІІ групи елементів VI та VII періодів.
– підрівень) – по 14. Вони утворюють побічні підгрупи ІІІ групи елементів VI та VII періодів.
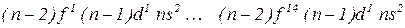
Всі вони є металами.
"Проскок" електрона.
Оскільки найбільш стійкими є конфігурації з наполовину або повністю заповненими підрівнями, для деяких елементів спостерігається "проскок" електрона.
Cr 
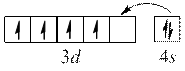
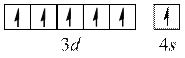
наполовину заповнений 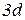 – підрівень.
– підрівень.
Cu 
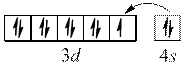
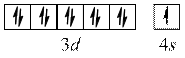
повністю заповнений 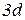 – підрівень.
– підрівень.
Отже, загальна електронна конфігурація елементів, у яких спостерігається "проскок" електрона:

Визначення, виходячи з будови електронних оболонок атомів, у якому періоді, групі, підгрупі знаходиться елемент:
ü номер періоду – найбільше значення головного квантового числа 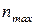 ;
;
ü номер групи – сума валентних електронів;
ü підгрупа – 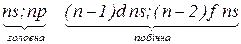
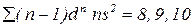 – елемент знаходиться в 8 групі побічній підгрупі.
– елемент знаходиться в 8 групі побічній підгрупі.
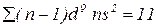 – елемент знаходиться в 1 групі побічній підгрупі.
– елемент знаходиться в 1 групі побічній підгрупі.
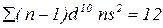 – елемент знаходиться в 2 групі побічній підгрупі.
– елемент знаходиться в 2 групі побічній підгрупі.
Дата добавления: 2015-09-02; просмотров: 946;
