Екранування.
Заряд ядра збільшується швидше, ніж головне квантове число (наприклад, за
n = 1, Z = 1 та 2; n = 2, Z = 3…10), можна очікувати, що енергія, необхідна для відщеплення електрона від атома, повинна збільшуватися зі збільшенням Z. Це не так.
І(Н) = 1312 кДж/моль
І(Li) = 520 кДж/моль
Менше значення енергії іонізації Li пояснюється:
ü середня відстань 2s – електрона від ядра більша, ніж 1s – електрона;
ü 2s – електрон атома Li відштовхується від внутрішніх 1s2 – електронів, що полегшує його відщеплення.
"Внутрішнє" відштовхування пояснюється також "екрануванням" ядра внутрішніми електронами, що спричиняє притягання валентних електронів лише часткою загального заряда ядра. Ця частка називається ефективним зарядом ядра Zеф.
Zеф(Li) = +1,3 (замість 3).
Електронна густина 1s – орбіталі знаходиться ближче до ядра, ніж густина 2s - орбіталі. Закони електростатики стверджують, що коли пробний заряд (2s – електрони) не накладається на інший заряд (1s – електрони), потенціал буде таким самим, якби цей інший заряд знаходився у центрі (в ядрі). Тоді валентному електрону на 2s – орбіталі відповідав би потенціал, еквівалентний одиничному ефективному заряду ядра (Zеф = 1,0).
Якби заряд 2s – електрона проникав у поле 1s – електрона, він був би екранований і відповідав би потенціалу, еквівалентному повному заряду ядра
(Zеф = 3,0).
За часткового проникнення енергія орбіталі 2s – електрона не змінюється, але енергія іонізації 2s – електрона визначається вже ефективним ядерним зарядом Zеф, який дещо менший дійсного заряду ядра:
Zеф = Z - S
S – константа екранування.
Завдяки наявності одного чи декількох максимумів електронної густини біля ядра s – орбіталі є сильно проникливими в орбіталі попередніх рівнів і менш екранованими електронами, які розташовані на цих попередніх рівнях, ніж орбіталі з більшим значенням l.
В свою чергу, s – орбіталі екранують в більшій мірі, ніж інші орбіталі. Найбільш проникливими та найменш екрануючими є орбіталі з високими значеннями l (d –та f – орбіталі).
Розрахунок константи екранування (за Слетером) на ns - або np – орбіталі:
а) записують електронну конфігурацію атома елемента як наступні групи орбіталей: (1s) (2s 2p) (3s 3p) (3d) (4s 4p) (4d) (4f) (5s 5p) (5d) (5f) …
б) електрони будь-якого угруповання справа від (ns np) – групи не уносять внеску у константу екранування;
в) приймають, що усі електрони цієї (ns np) – групи, що залишилися, екранують валентний електрон з внеском 0,35 на кожний з них;
г) припускають, що усі електрони на (n – 1) – рівні екранують з внеском 0,85 на кожний з них, усі електрони (n – 2) – рівня або нижче екранують валентний електрон повністю (внесок 1,00).
Якщо екранований електрон знаходиться у nd –або nf – групах, правила б) та в) залишаються, а правило г) змінюється: усі електрони в групах, які розташовані зліва nd –або nf – груп, вносять 1,00 у константу екранування.
Розрахунок Zеф для валентного 2р – електрона в атомі нітрогену:
згрупована електронна конфігурація (1s)2 (2s 2p)5
S = 2 ∙ 0,85 + (5-1) ∙ 0,35 = 3,10 (5ē 2s 2p мінус один, для якого проводиться розрахунок).
Zеф = Z – S = 7,0 – 3,1 = 3,9.
Розрахунок Zеф для валентного 4s – електрона в атомі цинку:
згрупована електронна конфігурація (1s)2 (2s 2p)8 (3s 3p)8 (3d)10 (4s)2
S = (2 + 8) ∙ 1,00 + (8 + 10) ∙ 0,85 + (2 – 1) ∙ 0,35 = 25,65 (2ē 4s мінус один, для якого проводиться розрахунок).
Zеф = Z – S = 30,0 – 25,65 = 4,35.
Розрахунок Zеф для валентного 3d – електрона в атомі цинку:
згрупована електронна конфігурація (1s)2 (2s 2p)8 (3s 3p)8 (3d)10 (4s)2
S = (2 + 8 + 8) ∙ 1,00 + (10 – 1) ∙ 0,35 = 21,15 (10ē 3d мінус один, для якого проводиться розрахунок).
Zеф = Z – S = 30,0 – 21,15 = 8,85.
Енергія іонізації залежить від ефективного заряду ядра, радіусу атома, екрануючої дії електронів:
а) 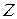 збільшується (більша взаємодія електрона з ядром),
збільшується (більша взаємодія електрона з ядром),  збільшується;
збільшується;
б) 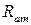 збільшується (менша взаємодія ē з ядром),
збільшується (менша взаємодія ē з ядром),  зменшується;
зменшується;
в) характер підрівнів (чим міцніше електрон на підрівні сполучений з ядром, тим важче його відщепити), 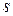 – електрон відщепити важче, ніж
– електрон відщепити важче, ніж 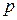 – електрон,
– електрон, 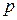 – електрон відщепити важче, ніж
– електрон відщепити важче, ніж 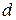 – електрон.
– електрон.
г) ефект екранування (  зменшується в міру збільшення числа екрануючих електронів);
зменшується в міру збільшення числа екрануючих електронів);
д) характер забудови електронами підрівнів: 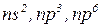 відрізняються підвищеною стійкістю.
відрізняються підвищеною стійкістю.
Наприклад, зміна енергії іонізації атомів елементів ІІ періоду:
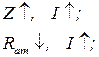
екрануюча дія електронів – однакова.
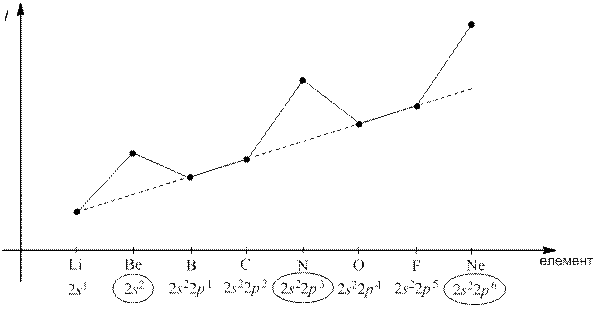
Енергія іонізації змінюється періодично. В межах періоду  зростає зліва направо, в головних підгрупах зменшується зверху вниз.
зростає зліва направо, в головних підгрупах зменшується зверху вниз.
Дата добавления: 2015-09-02; просмотров: 712;
