Уравнение состояния идеального газа
Уравнение состояния идеальногогаза устанавливает зависимость между основными термодинамическими параметрами (давление р, температура Т, удельный объем 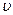 )
)
Идеальным газомназывается газ, в котором отсутствуют силы межмолекулярного взаимодействия, а объем молекул пренебрежимо мал. Важно, что при малом давлении (близком к атмосферному давлению) реальные газы с небольшой погрешностью можно считать идеальными газами.
Уравнение состояния идеального газа в 1834 г. установил французский физик Клапейрон.
Для 1 кг вещества уравнение Клапейрона имеет вид:
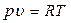 ,
,
где R – удельная газовая постоянная, 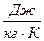 .
.
Удельная газовая постоянная R зависит от природы вещества и для разных газов она различна.
Для массы вещества М уравнение Клапейрона имеет вид:
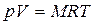 ,
,
где V – объем вещества, м3 , V = 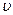 М;
М;
M – масса вещества, кг.
В 1874 г. русский ученный Менделеев применил уравнение Клапейрона к 1 киломолю вещества и получил универсальное уравнение состояния идеального газа, которое называется уравнением Менделеева-Клапейрона:
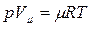 ,
,
где 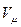 - объем киломоля,
- объем киломоля, 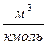 ;
;
μR – универсальная газовая постоянная, 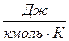 ;
;
Универсальная газовая постоянная μR (в некоторых учебниках она обозначается Rμ) не зависит от природы вещества и для всех газов одинакова:
μR = 8314 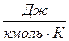 .
.
Существует однозначная взаимосвязь между универсальной газовой постоянной μR и удельной газовой постоянной вещества R, 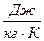 :
:
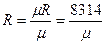 ,
,
где 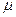 - масса киломоля вещества,
- масса киломоля вещества, 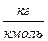 .
.
В технике широко применяется приведение газа или пара к определенным условиям. Для получения этих соотношений используем уравнение Клапейрона в виде
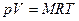 .
.
Разделим переменные и постоянные величины:
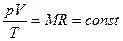 .
.
Следовательно, для любых состояний газа (при М=const) будет выполняться равенство соотношений:
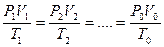 .
.
Пример. Определить во сколько раз измениться объем газа при нагреве от 20°C до 900°C, если давление и масса газа останутся неизменными.
Решение:
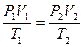 ;
;
откуда:
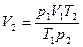 .
.
Учитывая, что р1 =р2 получим:
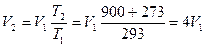 .
.
Ответ: объем газа при нагреве от 20°C до 900°C увеличится в 4 раза.
Дата добавления: 2015-09-11; просмотров: 2487;
