Рассмотрим некоторые примеры.
При влажности зерна 15—20% связанная вода составляет 10—15%. При большей влажности появляется свободная влага, способствующая усилению биохимических процессов (например, прорастанию зерна).
Плоды и овощи имеют влажность 75—95%. В основном, это свободная вода, однако примерно 5% влаги удерживается клеточными
коллоидами в прочно связанном состоянии. Поэтому овощи и плоды легко высушить до 10—12%, но сушка до более низкой влажности требует применения специальных методов.
Большая часть воды в продукте может быть превращена в лед при —5°С, а вся — при — 50°С и ниже. Однако определенная доля прочно связанной влаги не замерзает даже при температуре — 60°С.
"Связывание воды" и "гидратация" — определения, характеризующие способность воды к ассоциации с различной степенью прочности с гидрофильными веществами. Размер и сила связывания воды или гидратации зависит от таких факторов, как природа неводного компонента, состав соли, рН, температура.
Что же такое связанная вода? Надо сказать, что в ряде случаев термин "связанная вода" используется без уточнения его смысла, однако предлагается и достаточно много его определений. В соответствии с ними связанная влага:
— характеризует равновесное влагосодержание образца при некоторой температуре и низкой относительной влажности;
— не замерзает при низких температурах (—40°С и ниже);
— не может служить растворителем для добавленных веществ;
— дает полосу в спектрах протонного магнитного резонанса;
— перемещается вместе с макромолекулами при определении скорости седиментации, вязкости, диффузии;
— существует вблизи растворенного вещества и других неводных веществ и имеет свойства, значительно отличающиеся от свойств всей массы воды в системе.
Указанные признаки дают достаточно полное качественное описание связанной воды. Однако ее количественная оценка по тем или иным признакам не всегда обеспечивает сходимость результатов. Поэтому большинство исследователей склоняются к определению связанной влаги только по двум из перечисленных выше признаков. По этому определению, связанная влага — это вода, которая существует вблизи растворенного вещества и других неводных компонентов, имеет уменьшенную молекулярную подвижность и другие свойства, отличающиеся от свойств всей массы воды в той же системе, и не замерзает при — 40°С. Такое определение объясняет физическую сущность связанной воды и обеспечивает возможность сравнительно точной ее количественной оценки, т.к. вода, незамерзающая при — 40°С, может быть измерена с удовлетворительным результатом (например, методом ПМР или калориметрически). При этом действительное содержание связанной влаги изменяется в зависимости от вида продукта.
Причины связывания влаги в сложных системах различны. Наиболее прочно связанной является так называемая органически связанная
вода. Она представляет собой очень малую часть воды в высоковлажных пищевых продуктах и находится, например, в щелевых областях белка или в составе химических гидратов. Другой весьма прочно связанной водой является близлежащая влага, представляющая собой монослой при большинстве гидрофильных групп неводного компонента. Вода, ассоциированная таким образом с ионами и ионными группами, является наиболее прочно связанным типом близлежащей воды. К монослою примыкает мульmислойная вода (вода полимолекулярной адсорбции), образующая несколько слоев за близлежащей водой. Хотя мультислой — это менее прочно связанная влага, чем близлежащая влага, она все же еще достаточно тесно связана с неводным компонентом, и потому ее свойства существенно отличаются от чистой воды. Таким образом, связанная влага состоит из "органической", близлежащей и почти всей воды мультислоя.
Кроме того, небольшие количества воды в некоторых клеточных системах могут иметь уменьшенные подвижность и давление пара из-за нахождения воды в капиллярах. Уменьшение давления пара и активности воды (aw) становится существенным, когда капилляры имеют диаметр меньше, чем 0,1 цм. Большинство же пищевых продуктов имеют капилляры диаметром от 10 до 100 ц,м, которые, по-видимому, не могут заметно влиять на уменьшение aw в пищевых продуктах.
В пищевых продуктах имеется также вода, удерживаемая макромолекулярной матрицей. Например, гели пектина и крахмала, растительные и животные ткани при небольшом количестве органического Matериала могут физически удерживать большие количества воды.
Хотя структура этой воды в клетках и макромолекулярной матрице точно не установлена, ее поведение в пищевых системах и важность для качества пищи очевидна. Эта вода не выделяется из пищевого продукта даже при большом механическом усилии. С другой стороны, в технологических процессах обработки она ведет себя почти как чистая вода. Ее, например, можно удалить при высушивании или превратить в лед при замораживании. Таким образом, свойства этой воды, как свободной, несколько ограничены, но ее молекулы ведут себя подобно водным молекулам в разбавленных солевых растворах.
Именно эта вода составляет главную часть воды в клетках и гелях, и изменение ее количества существенно влияет на качество пищевых продуктов. Например, хранение гелей часто приводит к потере их качества из-за потери этой воды (так называемого синерезиса). Консервирование замораживанием тканей часто приводит к нежелательному уменьшению способности к удерживанию воды в процессе оттаивания.
В таблицах 10.3 и 10.4 описаны свойства различных видов влаги в пищевых продуктах.
Таблица 10.3.Категории свободной влаги в пищевых продуктах [Fennema, 1985]
| Свойства | Свободная | Вода в макромолекулярной матрице |
| Общее описание | Вода, которая может быть легко удалена из продукта. Вода— вода-водородные связи преобладают. Имеет свойства, похожие на воду в слабых растворах солей. Обладает свойством свободного истечения | Вода, которая может быть удалена из продукта. Вода-вода—водородные связи превалируют. Свойства воды подобны воде в разбавленных солевых растворах. Свободное истечение затруднено матрицей геля или ткани |
| Точка замерзания | Несколько ниже по сравнению с чистой водой | |
| Способность быть растворителем | Большая | |
| Молекулярная подвижность по сравнению с чистой водой | Несколько меньше | |
| Энтальпия парообразования по сравнению с чистой водой | Без существенных изменений | |
| Содержание в расчете на общее содержание влаги в продуктах с высокой влажностью (90% Н2О),% | ~ 96% | |
| Зона изотермы сорбции (рис. 10.6) | Вода в зоне III состоит из воды, присутствующей в зонах I и II, + вода, добавленная или удаленная внутри зоны III | |
| В отсутствие гелей и клеточных структур эта вода является свободной, нижняя граница зоны III нечеткая и зависит от продукта и температуры | В присутствии гелей или клеточных структур вся вода связана в макромолекулярной матрице. Нижняя граница зоны III нечеткая и зависит от продукта и температуры | |
| Обычная причина порчи пищевых продуктов | Высокая скорость большинства реакций. Рост микроорганизмов |
Таблица 10.4.Категории связанной влаги в пищевых продуктах [Fennema, 1985]
| Свойства | Органически связанная вода | Монослой | Мультислой |
| Общее описание | Вода как общая часть неводного компонента | Вода, которая сильно взаимодействует с гидрофильными группами неводных компонентов путем вода-ион, или вода — диполь ассоциации; вода в микрокапиллярах (d < 0, 1 μм) | Вода, которая примыкает к монослою и которая образует несколько слоев вокруг гидрофильных групп неводного компонента. Превалируют вода— вода и вода— растворенное вещество— водородные связи |
| Точка замерзания по сравнению с чистой водой | Не замерзает при - 40 °С | Не замерзает при - 40 °С. | Большая часть не замерзает при - 40 °С. Остальная часть замерзает при значительно пониженной температуре |
| Способность служить растворителем | Нет | Нет | Достаточно слабая |
| Молекулярная подвижность по сравнению с чистой водой | Очень малая | Существенно меньше | Меньше |
| Энтальпия парообразования по сравнению с чистой водой | Сильно увеличена | Значительно увеличена | Несколько увеличена |
| Содержание в расчете на общее содержание влаги в продуктах с высокой влажностью (90% Н2О), % | <0,03 | 0,1-0,9 | 1-5 |
| Зона изотермы сорбции (рис. 10.6) | Органически связанная вода показывает практически нулевую активность и, таким образом, существует в экстремально левом конце зоны I | Вода в зоне I изотермы состоит из небольшого количества органической влаги с остатком монослоя влаги. Верхняя граница зоны I не является четкой и варьирует в зависимости от продукта и температуры | Вода в зоне II состоит из воды, присутствующей в зоне I, + вода добавленная или удаленная внутри зоны II (мультислойная влага). Граница зоны II не является четкой и варьирует в зависимости от продукта и температуры |
| Стабильность пищевых продуктов | Самоокисление | Оптимальная стабильность при aw = 0,2-0,3 | Если содержание воды увеличивается выше нижней части зоны II, скорость почти всех реакций увеличивается |
471 :: 472 :: 473 :: 474 :: 475 :: Содержание
476 :: 477 :: Содержание
АКТИВНОСТЬ ВОДЫ
Давно известно, что существует взаимосвязь (хотя и далеко не совершенная) между влагосодержанием пищевых продуктов и их сохранностью (или порчей). Поэтому основным методом удлинения сроков хранения пищевых продуктов всегда было уменьшение содержания влаги путем концентрирования или дегидратации.
Однако часто различные пищевые продукты с одним и тем же содержанием влаги портятся по-разному. В частности, было установлено, что при этом имеет значение, насколько вода ассоциирована с неводными компонентами: вода, сильнее связанная, меньше способна поддержать процессы, разрушающие (портящие) пищевые продукты, такие как рост микроорганизмов и гидролитические химические реакции.
Чтобы учесть эти факторы, был введен термин "активность воды". Этот термин безусловно лучше характеризует влияние влаги на порчу продукта, чем просто содержание влаги. Естественно, существуют и другие факторы (такие как концентрация О2, рН, подвижность воды, тип растворенного вещества), которые в ряде случаев могут сильнее влиять на разрушение продукта. Тем не менее, водная активность хорошо коррелирует со скоростью многих разрушительных реакций, она может быть измерена и использована для оценки состояния воды в пищевых продуктах и ее причастности к химическим и биохимическим изменениям.
Активность воды (aw) — это отношение давления паров воды над данным продуктом к давлению паров над чистой водой при той же температуре. Это отношение входит в основную термодинамическую формулу определения энергии связи влаги с материалом (уравнение Ребиндера):
ΔF = L = RT∙ln
| Р0 |
| Рw |
= -RT∙lnaw ,
где ΔF — уменьшение свободной энергии (при постоянной температуре); L — работа отрыва 1 моля воды от сухого скелета материала (без изменения состава); R — универсальная газовая постоянная.
aw =
| Рw |
| Р0 |
=
| POB |
,
где Pw — давление водяного пара в системе пищевого продукта; Ро — давление пара чистой воды; РОВ — относительная влажность в состоянии равновесия, при которой продукт не впитывает влагу и не теряет ее в атмосферу, %.
По величине активности воды (табл. 10.5) выделяют: продукты с высокой влажностью (aw= 1,0—0,9); продукты с промежуточной влажностью (aw= 0,9—0,6); продукты с низкой влажностью (aw= 0,6—0,0).
Таблица 10.5.Активность воды (а ) в пищевых продуктах
| Продукт | Влажность, % | aw | Продукт | Влажность, % | aw | |
| Фрукты | 90-95 | 0,97 | Мука | 16-19 | 0,80 | |
| Яйца | 70-80 | 0,97 | Мед | 10-15 | 0,75 | |
| Мясо | 60-70 | 0,97 | Карамель | 7-8 | 0,65 | |
| Сыр | 0,92-0,96 | Печенье | 6-9 | 0,60 | ||
| Джем | 30-35 | 0,82-0,94 | Шоколад | 5-7 | 0,40 | |
| Хлеб | 40-50 | 0,95 | Сахар | 0-0,15 | 0,10 | |
| Кекс | 20-28 | 0,83 |
476 :: 477 :: Содержание
477 :: 478 :: 479 :: Содержание
Изотермы сорбции
Кривые, показывающие связь между содержанием влаги (масса воды, г Н2О/г С В) в пищевом продукте с активностью воды в нем при постоянной температуре, называются изотермами сорбции. Информация, которую они дают, полезна для характеристики процессов концентрирования и дегидратации (т.к. простота или трудность удаления воды связана с aw), а также для оценки стабильности пищевого продукта (что будет рассмотрено позже). На рис. 10.5 изображена изотерма сорбции влаги для продуктов с высокой влажностью (в широкой области влагосодержания).
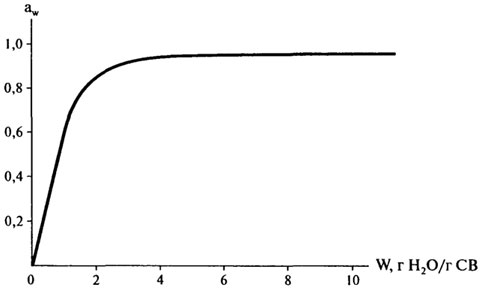
Рис. 10.5.Изотерма сорбции влаги для продуктов с высокой влажностью
Однако, с учетом наличия связанной влаги, больший интерес представляет изотерма сорбции для области низкого содержания влаги в пищевых продуктах (рис. 10.6).
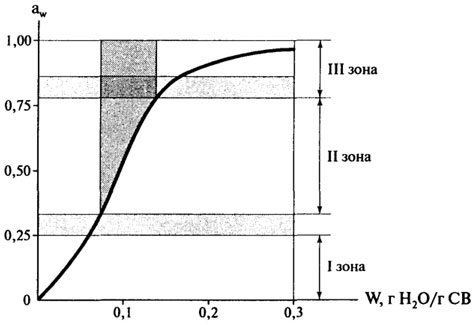
Рис. 10.6.Изотерма сорбции влаги для области низкого содержания влаги в пищевых продуктах
Для понимания значения изотермы сорбции полезно рассмотреть зоны I—III.
Свойства воды в продукте сильно отличаются по мере перехода от зоны I (низкие влагосодержания) к зоне III (высокая влажность). Зона I изотермы соответствует воде, наиболее сильно адсорбированной и наиболее неподвижной в пищевых продуктах. Эта вода абсорбирована, благодаря полярным вода-ион и вода-диполь взаимодействиям. Энтальпия парообразования этой воды много выше, чем чистой воды, и она не замерзает при — 40°С. Она неспособна быть растворителем, и не присутствует в значительных количествах, чтобы влиять на пластичные свойства твердого вещества; она просто является его частью.
Высоковлажный конец зоны I (граница зон I и II) соответствует монослою влаги. В целом зона I — соответствует чрезвычайно малой части всей влаги в высоковлажном пищевом продукте.
Вода в зоне II состоит из воды зоны I и добавленной воды (ресорбция) для получения воды, заключенной в зону II. Эта влага образует мультислой и взаимодействует с соседними молекулами через вода-вода—водородные связи. Энтальпия парообразования для мультислой-ной воды несколько больше, чем для чистой воды. Большая часть этой воды не замерзает при —40°С, как и вода, добавленная к пищевому продукту с содержанием влаги, соответствующим границе зон I и И. Эта вода участвует в процессе растворения, действует как пластифицирующий агент и способствует набуханию твердой матрицы. Вода в зонах II и I обычно составляет менее 5% от общей влаги в высоковлажных пищевых продуктах.
Вода в зоне III изотермы состоит из воды, которая была в зоне I и II, и добавленной для образования зоны III. В пищевом продукте эта вода наименее связана и наиболее мобильна. В гелях или клеточных системах она является физически связанной, так что ее макроскопическое течение затруднено. Во всех других отношениях эта вода имеет те же свойства, что и вода в разбавленном солевом растворе. ВоДа, добавленная (или удаленная) для образования зоны III, имеет энтальпию парообразования практически такую же, как чистая вода, она замерзает и является растворителем, что важно для протекания химических реакций и роста микроорганизмов. Обычная влага зоны III (не важно, свободная или удерживаемая в макромолекулярной матрице) составляет более 95% от всей влаги в высоковлажных материалах.
Состояние влаги, как будет показано ниже, имеет важное значение для стабильности пищевых продуктов.
В заключение следует отметить, что изотермы сорбции, полученные добавлением воды (ресорбция) к сухому образцу, не совпадают полностью с изотермами, полученными путем десорбции. Это явление называется гистерезисом.
Изотермы сорбции влаги для многих пищевых продуктов имеют гистерезис (рис. 10.7). Величина гистерезиса, наклон кривых, точки начала и конца петли гистерезиса могут значительно изменяться в зависимости от таких факторов, как природа пищевого продукта, температура, скорость десорбции, уровень воды, удаленной при десорбции.
Как правило, изотерма абсорбции (ресорбции) нужна при исследовании гигроскопичности продуктов, а десорбции — полезна для изучения процессов высушивания.
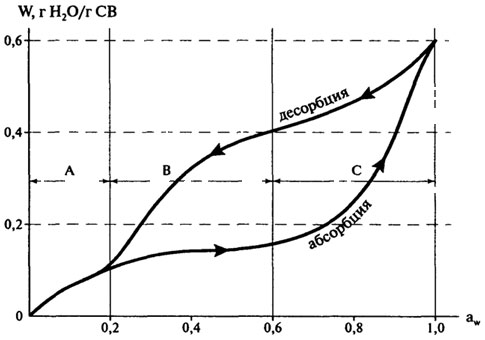
Рис. 10.7.Гистерезис изотермы сорбции влаги
477 :: 478 :: 479 :: Содержание
480 :: 481 :: 482 :: 483 :: 484 :: 485 :: 486 :: 487 :: Содержание
Дата добавления: 2015-11-18; просмотров: 1484;
