Лабораторная работа № 4. Тепловые эффекты реакций и растворения.
Тепловые эффекты реакций и растворения.
Цель: - определить тепловой эффект предлагаемой реакции; ознакомиться с тепловыми явлениями при растворении.
Оборудование и реактивы: технохимические весы, стакан на 100 мл с теплоизоляцией, мерный цилиндр на 25 мл, кристаллогидрат сульфата меди (П), цинковая пыль, хлорид натрия, нитрат аммония, гидроксид натрия.
Ход работы:
Опыт № 1. Определение теплового эффекта реакции замещения меди из раствора ее соли цинком.
Взвесьте на технохимических весах 5 г кристаллогидрата сульфата меди (II) и растворите их в 50 мл воды в стакане с теплоизоляцией. Замерьте и запишите температуру полученного раствора. Взвесьте 1,0 г цинковой пыли и всыпьте ее в раствор сульфата меди (II) . При помощи термометра определите максимальную температуру раствора. Количество выделившегося при реакции тепла рассчитайте по формуле
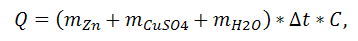
Где
С - удельная теплоемкость, равная приблизительно единице;
t -изменение температуры раствора, которая рассчитывается как разность между максимальной температурой раствора и температурой приготовленного раствора.
Полученный результат пересчитайте на 1 моль цинка и напишите термохимическое уравнение данной реакции.
Опыт № 2. Тепловые явления при растворении.
Налейте три стакана или колбы по 25 мл воды. Измерьте температуру воды. Взвесьте на технохимических весах 10 г хлорида натрия, 10 г нитрата аммония и 10 г гидроксида натрия. Затем всыпьте: в первый стакан хлорид натрия, во второй - нитрат аммония, в третий - гидроксид натрия (ОСТОРОЖНО!). Навески веществ энергично размешайте в воде и отметьте температуры полученных растворов. Как изменяется температура растворов гидроксида натрия, хлорида натрия и нитрата аммония? Объясните наблюдаемые явления.
Контрольные вопросы:
1. Напишите математическое выражение первого начала термодинамики. Что понимают под внутренней энергией?
2. Что изучает термохимия? Чем отличается химическое уравнение от термохимического?
3. Сформулируйте закон Гесса, приведите пример, иллюстрирующий этот закон.
4. Дайте определение теплоты растворения. Объясните, почему необходимо брать большое количество растворителя.
5. Составьте термохимическое уравнение, зная, что при сжигании 6, 5 г цинка выделилась теплота, соответствующая 34,8 кДж.
6. Вычислите тепловой эффект реакции при 298 К: 2Н2(г) * СО (г) = СН3ОН(ж) Энтальпии образования веществ при стандартных условиях следующие:
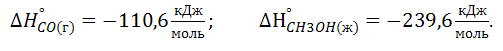
Дата добавления: 2015-11-10; просмотров: 4255;
