Скорость химических реакций и химическое равновесие.
Цель: - установление зависимости скорости реакции от концентрации реагирующих веществ, температуры; на примере образования роданида железа рассмотрения химического равновесия.
Оборудование и реактивы: штатив с пробирками, мерный цилиндр на 10-15 мл термометр, водяная баня или термостат, 0,1М тиорированные растворы хлорида железа (ш) и роданида аммония, кристаллический хлорид аммония.
Ход работы:
Опыт №1. Зависимость скорости реакции от концентрации.
Задание:
1. Зависимость скорости от концентрации легко проследить, пользуясь реакцией взаимодействия тиосульфата натрия с серной кислотой: Na2S2O3+H2SO4 > Na2SO4+H2O+SO2+S4v Момент сливания растворов нужно считать началом реакции, а появления мути от выпавшей в осадок серы - концом реакции. В три пробирки налейте 0,1м р-р тиосульфата натрия дистиллированной воды; во вторую - 10м Nа2S2O3 и 5мм воды; в третью -15мл р-ра Na2S2O3. Затем в каждую пробирку добавьте по 5мл 0,1м р-ра Н2504, отметьте время, прошедшее с момента добавления кислоты до момента появления мутности в каждой пробирке. Концом реакции считать одинаковую интенсивность помутнения. Результаты работы запишите в таблицу:
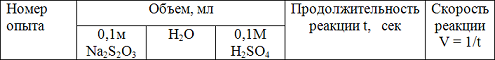
Написать выражение скорости реакции для данного процесса. Сделать выводы об изменении скорости реакции в проделанных опытах при увеличении концентрации тиосульфата натрия.
Опыт № 2. Зависимость скорости реакции от температуры. Зависимость скорости реакции от температуры также можно наблюдать, пользуясь реакцией взаимодействия тиосульфата натрия с серной кислотой. Налейте в три пробирки по 5 мл 0,1М р-ра Na2S2О2. Прилейте в первую пробирку 5 мл 0,1М 7р-ра H2SО4 и взболтайте раствор. Заметьте время, прошедшее с момента добавления кислоты до момента помутнения. Возьмите следующие Ъ мл 0,1М р-ра Na2S2O3 и 5 мл 0,1М р-ра H2SO4 и, не смешивая, нагрейте их на 10° выше комнатной температуры. Прилейте нагретый раствор кислоты к нагретому раствору тиосульфата и заметьте время, прошедшее с момента приливания до образования серы. Повторите опыт еще раз, но при температуре на 20° выше комнатной. Нагревать раствор можно в термостате или на водяной бане. Результаты опыта запишите в таблицу:

Сделайте выводы об изменении скорости реакции в проведенных опытах при повышении температуры на 10°, 20°.
Опыт № 3 Химическое равновесие. Примером обратимой реакции может служить взаимодействие между хлоридом железа (Ш) и роданидом аммония. Образующийся в результате реакции к моменту равновесия раствор роданида железа (Ш) имеет красный цвет, интенсивность которого зависит от его концентрации. Смешение равновесия легко наблюдать по изменению интенсивности окраски раствора роданида железа (Ш). В пробирку налейте 15 - 18 мл воды и прибавьте по 1 - 2 капли насыщенных растворов хлорида железа (Ш) и роданида аммония. Составьте уравнение данной реакции и запишите выражение константы равновесия. Полученный раствор красного цвета разлейте поровну в четыре пробирки. В первую добавьте 1мл насыщенного раствора хлорида железа (Ш), во вторую - 1мл насыщенного раствора роданида аммония. 8 третью пробирку положите несколько кристалликов хлорида аммония и взболтайте. Четвертую пробирку оставьте для сравнения. Как изменяется окраска растворов? Используя принцип Ле Шателье, объясните наблюдаемые изменения в исследуемой системе.
Контрольные вопросы:
1. Дайте определение скорости химической реакции. Запишите математическую формулу скорости химической реакции.
2. Сформулируйте закон действия масс. Каков физический смысл константы скорости, и какие факторы влияют на ее величину?
3. Как зависит скорость реакции от температуры?
4. Что такое энергия активации1? Какова зависимость между скоростью реакции и энергией активации?
5. Что называется катализом и катализатором? Какое влияние оказывает катализатор на энергию активации реакции?
6. Сформулируйте принцип Ле Шателье. Объясните влияние температуры, концентрации и давления на реакцию синтеза аммиака.
Основные понятия и законы термодинамики. Термохимия.
Термодинамика изучает законы взаимного превращения различных видов энергии. В химической термодинамике рассматривают основные термодинамические законы применительно к химическим и физическим процессам. Она базируется на двух началах термодинамики, являющихся обобщением практического опыта. Первое начало термодинамики - это по существу закон сохранения и превращения энергии применительно к термодинамическим процессам. Все виды энергии являются соответствующими формами движения материи и закон сохранения энергии выражает неуничтожаемость движения. В изолированной системе энергия может только превращаться из одной формы в другую, но ее количество остается постоянным. Изменение энергии в системе происходит при совершении работы и при передаче системе какого-то количества теплоты. Математически первое начало термодинамики записывается Q=AU+A, Q = (U2-U1) + A, где U1 и U2 - внутренняя энергия системы в начальном и конечном состояниях. Теплота Q, подводимая к системе, идет на изменение внутренней энергии ?U и на совершение работы против внешних сил А. Под внутренней энергией понимают энергию, которая заключена в любом .теле независимо от его агрегатного состояния и складывается из кинетической энергии движения электронов, электрической энергии взаимодействия электронов друг с другом и с атомными ядрами, внутриядерная энергия, энергия взаимодействия молекул друг с другом и т.д. Внутренняя энергия не включает потенциальную энергию положения всего тела в пространстве и кинетическую энергию его движения. Внутренняя энергия измеряется в джоулях или килоджоулях (Дж, кДж), отнесенных к 1 моль вещества. Внутренняя энергия или увеличивается притоком энергии извне, или уменьшается, переходя в окружающее пространство в виде теплоты, работы. Термохимия. Химические реакции, сопровождающиеся выделением (экзотермический процесс) или поглощением (эндотермический процесс) теплоты. Раздел физической химии, занимающийся изучением тепловых эффектов химических реакций и переходов из одного агрегатного состояния в другое, называется термохимией. Если химическая реакция протекает при постоянном объеме, то, согласно первому началу термодинамики, работа расширения не совершается (А=0), а потому Qv = дельтаU. Если химическая реакция протекает при постоянном давлении, то системой будет производиться работа расширения, а тепловой эффект равен: Qp = дельтаН, Где Н = pV - энтальпия. Запись химической реакции с указанием теплового эффекта (и его знака) называют термохимическим уравнением. Термохимические уравнения обычно относят к I моль образующегося вещества. Так как одно и то же вещество в различных агрегатных состояниях или кристаллических модификациях обладает разной внутренней энергией, что отразится на тепловом эффекте реакции, в термохимических уравнениях обязательно указывают агрегатное состояние вещества (г - газ; ж - жидкость; т -твердое) и его кристаллическую форму: С(т) + O2(г) = СO2(г) + 393,62 кДж Закон Гесса. Основным законом термохимии является закон Гесса (1840), согласно которому тепловой эффект химической реакции зависит только от исходного и конечного состояния веществ, но не зависит от промежуточного состояний и пути перехода.Закон Гесса строго соблюдается только для процессов, протекающих при постоянном давлении (тогда Qp = ?Н) или при постоянном объеме (тогда Qv = ?U). Теплота растворения. Процесс растворения в большинстве случаев представляет собой наложение двух процессов: физического и химического, так как происходит взаимодействие частиц с растворителем, и в то же время равномерное их распределение по всему объему. Растворение твердых веществ складывается из нескольких процессов, каждый из которых сопровождается тепловым эффектом: 1) разрушение кристаллической решетки -Q1; 2) процесс сольватации +Q2; 3) процесс диффузии, но этот эффект настолько мал, что его не учитывают. Следовательно, теплота растворения твердого тела определяется алгебраической суммой двух теплот: Qраств = (Q1)+(Q2). У солей с прочной кристаллической решеткой и не обладающих склонностью к сольватации, а также у кристаллогидратов NaNО3, КС1, NH4Cl, KBr, CuSO4, 5H2O и т.д.) растворение сопровождается поглощением теплоты. Для правильного определения теплоты растворения большое значение имеет количественное отношение растворенного вещества и растворителя. При увеличении количества растворителя теплота растворения приближается к постоянной величине. Поэтому теплотой растворения принято называть количество теплоты, выделяемой или поглощаемой системой при растворении 1 моль вещества в таком количестве растворителя, при котором дальнейшее прибавление растворителя уже не изменяет тепловой эффект растворения.
Дата добавления: 2015-11-10; просмотров: 1599;
