Химическая кинетика и катализ. Химическое равновесие.
Химическая кинетика изучает скорость и механизм химических реакций, а также влияние на них различных факторов - природы и концентрации реагирующих веществ, температуры, катализаторов и др. Под скоростью химической реакции понимают изменение концентрации одного из реагирующих веществ в единицу времени. Если обозначить концентрацию через с, а время через т, то изменение концентрации с2 – C1 в данный промежуток времени т2 – т1 определяют среднюю скорость реакции:
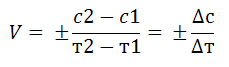
Зависимость скорости реакции от концентрации веществ в химической кинетике выражается законом действующих масс, согласно которому скорость химической реакции при постоянной температуре в каждый данный момент пропорциональна произведению концентраций реагирующих веществ, взятых в степени, равной стехиометрическому коэффициенту, данного вещества в уравнении реакции-Каждому типу реакции соответствует определенная зависимость ее скорости от концентрации.
Для химической реакции nA+mB dC+fD скорость равна
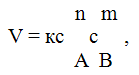
Где
сА И св концентрация исходных веществ А и В, моль/л;
n и m -стехиометрические коэффициенты;
к - константа скорости реакции.
Уравнение зависимости скорости реакции от концентрации называется кинетическим уравнением реакции. При сA = сB = 1, v = к, т.е. константа скорости реакции равна скорости реакции при концентрации реагирующих веществ, равных единице. Константа скорости зависит от природы реагирующих веществ, температуры, катализатора и его концентрации, от среды, в которой протекает реакция, но не зависит от концентрации. Скорость химической реакции зависит от многих факторов; наиболее изучено влияние температуры. С повышением температуры скорость химических реакций возрастает. Согласно эмпирическому правилу Вант -Гоффа при повышении температуры на 10 градусов скорость химической реакции увеличивается в 2 - 4 раза. Это правило применимо для реакций, протекающих при сравнительно невысоких температурах. Для более широкого интервала температур используют уравнение Аррениуса
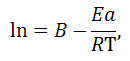
Где
к - константа скорости реакции;
R - молярная газовая постоянная;
В - постоянная для данной реакции;
Т - абсолютная температура;
Еа-энергия активации.
Энергия активации — то избыточное количество энергии, по сравнению со средней величиной, которой должна обладать молекула в момент столкновения, чтобы быть способной к химическому взаимодействию. Для химических реакций энергия активации колеблется от 50 до 400 кДж/моль. Молекулы, обладающие такой энергией, считаются активными. Энергия активации является энергетическим барьером химической реакции, а потому чем меньше энергия активации, тем больше число активных молекул, а следовательно, и скорость химической реакции. Катализ. Изменение скорости химической реакции пол влиянием катализатора называется катализом. Катализаторами называются вещества, которые, участвуя в процессе, изменяют скорость химической реакции, но остаются неизменными по количеству и химическому составу. Различают два вида катализа: гомогенный и гетерогенный. Механизм действия катализатора в большинстве случаев сводится к снижению энергии активации. Катализатор одинаково изменяет энергию активации прямого и обратного процессов, Химическое равновесие, как известно, большинство химических реакций идет до состояния равновесия, при котором в смеси находятся как исходные вещества, так и продукты реакции. Это так называемые обратимые реакции. Химическая система находится в равновесии, если ее состояние во времени не изменяется при заданных внешних условиях (температуре, давлении). Переход системы от одного состояния равновесия к другому называется смешением или сдвигом химического равновесия. Направление смешения химического равновесия при изменениях концентрации, температуры и давления определяется принципом подвижного равновесия (принципом Ле Шателье). Если на систему, находящуюся в равновесии, воздействовать извне изменяя какое-нибудь из условий равновесия, то в системе усилится то из направлений процесса, течение которого ослабляет это воздействие.
Дата добавления: 2015-11-10; просмотров: 1770;
