Расчеты горения топлива
При горении топлива в качестве окислителя используют кислород воздуха. В результате образуются продукты сгорания и развивается определенная температура горения. Поэтому расчеты горения топлива выполняются с целью определения:
а) количества необходимого для горения воздуха;
б) количества и состава продуктов сгорания;
в) температуры горения.
Расход воздуха
Расходы воздуха можно определять как в объемных, так и в массовых единицах.
Для уяснения методики определения расхода воздуха рассмотрим полное горение метана (СН4) по реакции СН4 + 2О2 = СО2+2Н2О.
Сначала определим расход воздуха в объемных единицах. Как следует из приведенной реакции, для сжигания 1 моля СН4 требуется 2 моля О2. Поскольку 1 кмоль любого газа занимает при нормальных условиях одинаковый объем (22,4 м3), то для сжигания 22,4 м3 СН4 потребуется 2×22,4=44,8 м3 О2. Таким образом, для сжигания 1 м3 СН4 требуется 2 м3 О2, но в сухом воздухе кислород по объему составляет 21%, остальные 79% приходятся на долю азота. Следовательно, количество азота в воздухе в 3,762 раза больше количества кислорода. Поэтому расход воздуха на сжигание 1 м3 метана составит 2+2×3,762=9,524 м3.
Аналогичный расчет можно провести и в массовых единицах. Подобные расчеты чаще делают для твердого или жидкого топлива. Возьмем, например, горение углерода С + О2 = СО2. Из этой реакции видно, что на 1 кмоль С расходуется 1 кмоль О2, но 1 кг×моль С имеет массу, равную 12 кг, а кг×моль О2 32 кг; следовательно, для сжигания 1 кг С потребуется 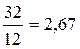 кг кислорода. В воздухе кислород по массе составляет 23,2%, а азот 76,8%. Поэтому вместе с кислородом войдет азота
кг кислорода. В воздухе кислород по массе составляет 23,2%, а азот 76,8%. Поэтому вместе с кислородом войдет азота 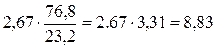 кг.
кг.
Следовательно, для сжигания 1 кг углерода потребуется воздуха 2,67+8,83=11,50 кг. Это количество можно перевести в объемное, поделив общую массу воздуха на его плотность (1,293 кг/м3), т.е. 11,50/1,293=8,89 м3.
Как при горении метана, так и при горении углерода полученные по реакциям количества кислорода и воздуха представляют собой те наименьшие количества, которые необходимы для полного окисления единицы горючего вещества. Такое наименьшее необходимое количество воздуха (кислорода) называется теоретическим количеством. На практике, однако, сжигание топлива осуществляется при расходах воздуха, несколько превышающих теоретическое количество. Величина, показывающая отношение действительного расхода воздуха (Vд) к теоретическому количеству (Vт), называется коэффициентом избытка воздуха п =Vд/Vти играет на практике очень важную роль.
Более универсальной величиной является коэффициент расхода кислорода (п0), который показывает отношение действительного расхода кислорода ( 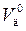 ) к теоретически необходимому (
) к теоретически необходимому ( 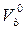 ), т.е.
), т.е. 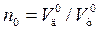 .
.
Коэффициент избытка воздуха пригоден только для полного сгорания топлива в воздухе.
При неполном же сгорании, когда подаваемое количество кислорода меньше теоретического, применим только коэффициент расхода кислорода, который становится меньше единицы. При применении обогащенного дутья, в котором количество кислорода превышает 21%, характерным также является коэффициент расхода кислорода. В этом случае метод определения расхода дутья аналогичен выше изложенному с той лишь разницей, что изменяется соотношение между азотом и кислородом.
Всякое промышленное топливо представляет собой механическую или химическую смесь отдельных горючих элементов, поэтому общий расход воздуха (кислорода) определяется суммированием аналогичного расхода для отдельных элементов.
Состав и количество продуктов сгорания
Состав и количество продуктов сгорания определяют по методу, применяемому для определения расхода воздуха. Рассмотрим снова пример полного горения метана при коэффициенте избытка, равном единице. В результате горения образуются СО2 и Н2О. Кроме того, в продуктах сгорания будет присутствовать N2, внесенный с воздухом.. Определим последовательно количество каждой составляющей продуктов сгорания. При сжигании 1 м3 метана образуется СО2 1м3 и Н2О 2 м3. Кроме того, с воздухом вносится 2×3,762 = 7,524 м3 N2. Таким образом, полное количество продуктов сгорания составит 1 м3 + 2 м3 + 7,524 м3 = 10,524 м3.
Состав продуктов сгорания следующий:
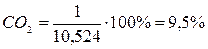 ;
;
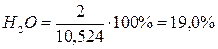 ;
;
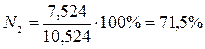 ;
;
Если бы СН4 сжигали с коэффициентом избытка воздуха, превышающим единицу, то общее количество продуктов сгорания возросло бы в связи с увеличением количества азота и наличием в продуктах сгорания избыточного кислорода.
При сжигании топлива в обогащенном кислородом воздухе наблюдается обратная картина.
При расчетах горения необходимо составлять материальный баланс процесса, путем определения исходных веществ и продуктов сгорания.
Температура горения
Под температурой горения понимают ту температуру, которую приобретают продукты сгорания в результате сообщения им тепла, выделенного при сжигании. Различают теоретическую и калориметрическую температуру горения.
Продукты сгорания топлива нагреваются до высоких температур, при которых возможна диссоциация СО2 и Н2О, достигающая иногда 10%. В результате диссоциации происходит изменение объема и уменьшается выделяемое количество тепла, так как в процессе диссоциации поглощается тепло. Теоретическая температура горения определяется с учетом диссоциации в продуктах сгорания, т.е.
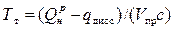 ,
,
где 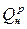 — теплота сгорания топлива, Дж/м3, или Дж/кг;
— теплота сгорания топлива, Дж/м3, или Дж/кг;
qдисс — тепло, пошедшее на процесс диссоциации, Дж;
Vпр — объем продуктов сгорания, образующихся при сгорании единицы топлива, м3;
с — удельная теплоемкость продуктов сгорания, кДж/(м3×К).
Калориметрическая температура определяется из условия, что все выделившееся при горении тепло расходуется только на повышение температуры продуктов сгорания. Иными словами, калориметрическая температура горения определяется для адиабатных условий, когда отсутствует теплообмен с внешней средой. Следовательно, 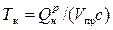 .
.
При наличии подогретого воздуха (или топлива) калориметрическую температуру можно определить из выражения
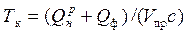 ,
,
где Qф — физическое тепло подогрева воздуха и топлива.
На практике обычно определяют калориметрическую температуру горения, которая является одной из характеристик топлива.
Расчет калориметрической температуры выполняют из условий полного сгорания топлива следующим образом. Продукты сгорания любого топлива представляют собой смесь различных газообразных составляющих СО2, Н2О, N2, О2, SО2. Каждой из этих составляющих при той или иной температуре присуща вполне определенная величина теплоемкости. Это дает возможность определить теплоемкость продуктов сгорания в целом для соответствующей температуры.
Энтальпия продуктов сгорания, как смеси газов, определяют аналогично определению теплоемкости продуктов сгорания.
Количество тепла, которое выделяется при горении единицы топлива, равно произведению энтальпии на объем продуктов сгорания, образовавшихся от сгорания единицы топлива Q = IV.
Однако возможна и обратная постановка задачи. Дело в том, что для продуктов сгорания определенного состава каждой величине теплоемкости 1 м3 продуктов сгорания соответствует вполне определенная температура. Другой теплоемкости будет соответствовать и другая температура. Подобный метод определения температуры по величине теплоемкости (или энтальпии) продуктов сгорания широко применяется в расчетах.
Дата добавления: 2015-11-10; просмотров: 7943;
