Методы физико-химического анализа и исследования ТП
Методы исследования ТП. Как уже говорилось ранее в технологии ЭС используются разнообразные физико-химических процессы, в которых происходят сложные физические явления в паровой, газовой и жидкой фазах, а также в вакууме, на поверхности и внутри твердых тел, на границах раздела сосуществующих твердых, жидких, паровых и плазменных фаз. Протекание этих процессов, их механизм и конечные результаты определяются прежде всего характером межмолекулярного взаимодействия сосуществую-щих сред. Различают два типа сред: обрабатываемую (обычно твердую, реже жидкую) и обрабатывающую, которая может находиться в любом из агрегатных состояний.
В общем случае цели технологической обработки могут быть различными: получение твердых слоев различных материалов, очистка поверхности, травление, легирование, формообразование и т. п. Однако во всех случаях эти цели определяются или задаются параметрами качества (электрофизическими, механическими, геометрическими, оптическими, химическими и др.) изделия и (или) полуфабриката. Основная особенность технологии ЭС состоит в том, что полученные электрофизические характеристики должны обеспечивать заданные электронные или радиотехнические функции изделия, которые, в свою очередь, зависят от сложного комплекса физических явлений.
Технология ЭС — от получения исходных материалов до испытания готовых изделий — предназначена для изготовления такого устройства, которое отвечало бы поставленным техническим и экономическим требованиям. При анализе и исследовании ТП возможны 2 конечных результата: либо усовершенствование ТП, либо разработка нового варианта ТП. В первом случае ТП представляют в виде большой системы, описываемой определенным числом детерминированных и стохастических закономерностей. Анализируемая система разбивается на ряд подсистем, состоящих из аппаратурно-процессных единиц (АПЕ), обслуживающих коммуникаций и контрольно-измерительных комплексов. В каждой подсистеме производятся определенные (детерминированные) технологические процедуры при заданных граничных условиях на параметры качества обрабатываемого полуфабриката на ее входе и выходе. Параметры полуфабриката на входе и выходе АПЕ проверяют с определенной степенью точности на соответствие своему назначению. Системный анализ и исследование АПЕ рациональнее проводить тремя методами: термодинамическим, молекулярно-кинетическим и стохастическим.
Термодинамический метод исследования применяют для определения классических термодинамических характеристик ТП, т. е. оптимальных значений термодинамических параметров состояния системы (температуры, давления, состава, дисперсности, энергии и т. п.) для заданных параметров качества изделия и экономических показателей; а также его информационно-энтропийных характеристик, т. е. флуктуации параметров качества исходных материалов и термодинамических факторов процесса, влияющих на конечные значения параметров качества полуфабриката и (или) изделия.
Таким образом, находят оптимальную область параметров качества изделий в пространстве термодинамических факторов, влияющих на значения этих параметров. В результате проведенного исследования строят физико-математическую модель, детерминировано связывающую параметры качества изделия и воздействующие термодинамические факторы ТП. Подобные исследования осуществляют обычно методами планирования экстремальных экспериментов, что позволяет получить функциональные зависимости параметров качества от технологических факторов в виде уравнений регрессий.
Существенным недостатком таких исследований является резкое изменение коэффициентов уравнения регрессии при смене материала, технологической установки или ее конструктивных элементов.
Молекулярно-кинетический метод исследования позволяет определить кинетические характеристики потоков массы (газов, паров, твердых и жидких частиц) и параметров состояния (температуры, концентраций, давлений, полей и т. п.) и исследовать механизмы молекулярного взаимодействия сред и возникающие в результате этого структурные изменения в системе.
Целью кинетических исследований является установление закономерностей, связывающих изменение параметров качества полуфабрикатов во времени с факторами ТП, а также определение максимальной скорости его протекания при различных условиях, т. е. максимальной производительности процесса.
Стохастический метод исследования применяется для определения места и причин возникновения флуктуации параметров полуфабрикатов и факторов ТП, их значений и влияния на качественные (точностные) характеристики полуфабрикатов или изделия в целом. Результатом стохастического анализа является построение точностных диаграмм АПЕ и технологических линий при заданных параметрах полуфабрикатов и факторах ТП. Если в начале такого исследования степень неопределенности (информационная энтропия) ТП обычно велика, то после получения теоретических и экспериментальных данных она резко снижается. Степень уменьшения энтропии (энтропийного фактора) характеризует результаты исследований и анализа ТП.
Выбор количественной оценки энтропии ТП в общем случае — задача нетривиальная, так как она характеризует степень нашего незнания (степень неизученности) процесса, поэтому может выражаться различными функциями. В технологии ЭС значение энтропии S (энтропийного фактора) принимают равным логарифму выхода годных изделий (Г) при заданных параметрах качества изделий или полуфабрикатов втечение всего ТП, в аппаратурно-процессной единице или на одной операции:
S=klgГ,
где k — коэффициент пропорциональности.
Выход годных изделий Г, который можно интерпретировать как статистический вес состояния системы, есть вероятностная величина, равная отношению числа годных изделий ко всей совокупности изделий или полуфабрикатов. Логарифм выхода годных изделий изменяется от нуля (при Г=1) до бесконечности (при Г=0).
Поскольку энтропия — величина аддитивная, сумма значений энтропии отдельных АПЕ, составляющих технологическую систему, равна энтропии этой системы:
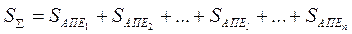 |
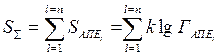 или
или
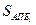 |
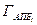 где —
где — 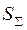 энтропия (информационная) технологической системы; , —энтропия отдельной (i-й) АПЕ; п — число АПЕ; —выход годных изделий на отдельной (i-й) АПЕ.
энтропия (информационная) технологической системы; , —энтропия отдельной (i-й) АПЕ; п — число АПЕ; —выход годных изделий на отдельной (i-й) АПЕ.
Из анализа данных уравнений следует, что суммарная энтропия ТП может возрастать за счет увеличения энтропии какой-либо одной или нескольких АПЕ, что заставляет исследователя сконцентрировать внимание на изучении этих аппаратурно-процессных единиц.
Предположим, что требуется изменить (улучшить) параметры изделия, т.е. изменить условия его годности. В этом случае при существующем процессе заведомо значение выхода годных будет меньше, а энтропии больше, чем в предыдущем случае. При недостаточном количестве или полном отсутствии годных изделий получают соответственно большее или равное бесконечности значение энтропии. Следовательно, данный ТП неприемлем для достижения поставленных целей.
Лекция №2
Принципы анализа физико-химических процессов технологии ЭС.Методы физической химии позволяют приближенно оценить направление многих процессов при заданных параметрах состояния, а следовательно, и при выбранных режимах ТП. Такой анализ применительно к различным ТП изготовления ЭС рассматриваетсявсоответствующих дисциплинах. Однако при этом часто не принимают во внимание флуктуационные явления. Между тем при изготовлении приборов с микронными, субмикронными и нанометровыми размерамиэлементов флуктуации играют решающую роль. |Во многих процессах, например при получении и травлении тонких пленок, легировании методами диффузии и имплантации, фотолитографии и др., в результате флуктуации технологических режимов (факторов) обработки, а также характеристик обрабатывающей среды (растворов, паров, газов, плазмы, лучей и т. п.) появляются статистически распределенные неоднородности свойств обрабатываемой среды, т. е. флуктуации свойств в пределах данного микроансамбля (структуры, платы, кристалла и т. п.) Используя методы статистической термодинамики, удобно анализировать процессы, протекающие при формировании элементов радиоэлектронных устройств микронных и субмикронных размеров.
Основными понятиями статистической термодинамики являются: большой канонический ансамбль, микроканонический ансамбль, фазовое пространство импульсов и координат, энергия. Аналогами этих понятий в технологии РЭА могут служить соответственно генеральная совокупность изделий *, выборка, число степеней свободы изменения параметров изделия и технологических факторов ит. п.
Однако есть существенное различие в принципах применения математической статистики к равновесной термодинамике и технологии. Если любая термодинамическая система описывается тремя основными параметрами (энергией, импульсом и моментом импульса), то в случае технологической системы таких параметров (влияющих факторов) значительно больше. Поэтому статистический анализ целесообразно применять лишь для исследования флуктуации процесса и воздействий на него. При этом анализ позволяет решить проблемы точности и стабильности (устойчивости) TП.
Как в статистической термодинамике, чтобы начать статистическое описание системы, следует задать ее состояние, так и при статистическом исследовании технологической системы нужно сначала выбрать конкретный детерминированный физико-химический процесс, оценить степень его стохастичности и только затем приступать к его статистическому описанию и анализу. Фактически такой анализ сводится к исследованию влияния флуктуации технологических факторов на распределение параметров качества изделий в выбранной совокупности (выборке). При этом технологическими считают термодинамические, кинетические и стохастические факторы. Среди них определяют значащие, незначащие и, главное, доминирующие.
Для поддержания на заданном уровне значений тех или иных влияющих и, особенно, доминирующих технологических факторов разрабатывают системы контроля и управления и на их основе автоматизируют ТП.
Естественно, что автоматизировать управление ТП, в основе которого лежит тот или иной физико-химический процесс, невозможно без построения адекватной его математической модели. Резко повысить эффективность анализа физико-химических процессов технологии РЭА можно за счет разработки имитационных моделей, привлекая для работы с такими моделями средства информационно-вычислительной техники. Методика анализа таких моделей постоянно совершенствуется, разрабатываются автоматизированные системы анализа на базе новейших научных данных, которые ориентируются на использование программно-вычислительных возможностей современных ЭВМ.
Анализ физико-химических процессов должен быть причинным, т. е. выявлять причины того или иного явления, отклонений от найденных ранее закономерностей и т. п. Такой анализ применительно к физико-химическим процессам технологии РЭА только начинает развиваться. Таким образом, физико-химический анализ ТП, поскольку ТП является большой системой, должен быть системным, т. е. отражать всю совокупность связей между элементами системы (объектами, факторами, параметрами и т. п.).
Важно, чтобы анализ ТП как физико-химической системы осуществлялся в динамике, т. е. проявлении функций системы во времени. Поэтому, если равновесная система описывается фазовым пространством состояний, то функционирующую систему можно описать только уравнениями движения в пространстве состояний, что значительно затрудняет анализ ТП по сравнению с классическим физико-химическим анализом. Однако это дает большой простор инженеру-технологу для проявления своего творческого потенциала для повышения эффективности ТП, а, следовательно, и производства в целом.
Основные понятия и способы описания термодинамической и технологической систем
В технологии ЭС используется большое количество процессов, описываемых с помощью термодинамических, кинетических и статистических законов. К таким процессам относятся физическое ифизико-химическое осаждение и растворение слоев, электрохимические, плазменные, диффузионные процессы, создание контактов идр. Большинство технологий построено на процессах, связанных свысокими концентрациями энергий в обрабатываемых материалах, особенно в приповерхностных слоях, где формируются рабочие элементы ЭС. Это приводит к возникновению неравновесных состояний (напряжений). Электрофизические свойства твердых тел, реализуемых в ЭС, зависят от этих состояний, определяемых типом иконцентрацией дефектов в твердом теле. Большинство электрофизических свойств полуфабрикатов ЭС, аследовательно, и выход годных изделий зависят от характера сил связей между атомами в слоях твердого тела и статистического распределения возможных дефектов в структуре этих слоев. Поэтому для анализа исинтеза ТП до описания физико-технологических процессов изготовления ЭС необходимо рассмотреть основы классической и статистической термодинамики, атакже кинетические закономерности.
Термодинамика как один из основных разделов теоретической физики изучает законы взаимных превращений энергии вравновесных процессах и направление самопроизвольных процессов в системе взаимодействующих макро- и микроскопических тел. При установлении основных термодинамических закономерностей, какправило, не детализируются сложные энергетические превращения, протекающие внутри тела. Не дифференцируются такжевиды энергии, присущие телу в данном состоянии. Совокупность этих видов энергии рассматривается какединая внутренняя энергия системы.
Положения классической термодинамики не применимы котдельным атомам и молекулам, так как для них понятия теплоты иработы теряют смысл. Поэтому в термодинамике анализируют лишь большие ансамбли атомов и молекул, составляющие системы. При этом свойства и поведение отдельных молекул не учитывают. Макроскопическую систему, выделяемую в термодинамичеcкую, в дальнейшем будем называть просто системой. Она имеет определенные границы, отделяющие ее от окружающей среды. Так вот термодинамика в первую очередь изучает физико-химические явления и процессы, сопровождающие энергетическое и материальное взаимодействие системы с внешней средой. Характер этого взаимодействия определяется граничными поверхностями, которые либо непроницаемы для потоков вещества и энергии, либо прозрачны только для энергетических потоков, либо для обоих. В соответствие с этим системы подразделяются на замкнутые, закрытые и открытые (см. рис.1).
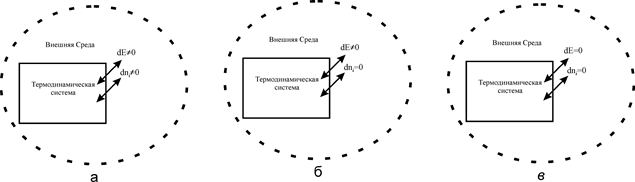
Рис.1. Термодинамические системы:
а-открытые; б-закрытые; в-замкнутые
Открытые системы способны обмениваться веществом и энергией с внешней средой (dE¹0; dn¹0). Большинство реальных систем относится к открытым. В общем случае входящие ы выходящие потоки могут выводить такие системы из термодинамического равновесия и удерживать неопределенно долго в равновесном стационарном состоянии (состоянии текущего равновесия).
В закрытых системах (рис. 1,б) через граничные поверхности возможен лишь энергетический обмен (dE¹0), а массообмен отсутствует (dn=0). Но массы отдельных компонентов внутри системы могут измениться в результате химических реакций внутри системы. Пример космический корабль.
В замкнутых системах (рис. 1,в) полностью отсутствует любой обмен с внешней средой (dE=0; dn=0). Условно эту систему можно смоделировать как идеально термостатированный объект с абсолютно непроницаемыми граничными поверхностями.
Принципиальным отличием замкнутых систем от открытых является поведение во времени. В замкнутых равновесных системах поток любого термодинамического параметра, направленный в одну сторону, компенсируется таким же по значению но направленным противоположно потоком. Можно сказать, что закрытая система инвариантна относительно времени, т.е. дифференциальные уравнения описывающие данные системы инвариантны по отношению к преобразованию
«t» » «-t».
Системы разделяются по виду внутреннего содержания на гомогенные и гетерогенные.
Систему называют гомогенной, если все ее параметры одинаковы во всех частях или непрерывно меняются от точки к точке.
Систему называют гетерогенной, если она состоит из частей, разделенных видимыми поверхностями раздела. На этих поверхностях некоторые параметры системы меняются скачкообразно.
Совокупность отдельных гомогенных частей системы, обладающих одинаковыми свойствами, может условно считаться одной фазой (например, смесь кристаллов одного вещества или совокупность капелек жидкости, взвешенных в газе и составляющих туман, ит. п.).
Состояние и макроскопические свойства любой термодинамической системы полностью и однозначно определяются заданием некоторого числа внутренних параметров, которые называются термодинамическими параметрами состояния.
Исходные термодинамические параметры состояния выбираются произвольно, но, после выбора, все другие переменные оказываются фиксированными. Выбранные переменные, определяющие состояние системы, называются независимыми. Параметры, которые можно выразить через исходные, являются зависимымипеременными.
В отличие от классической химии при термодинамическом описании процессов требуется дополнительные сведения, касающиеся условий их протекания и фазового состояния компонентов.
Например, реакции
2Н2(g) + О2(g) = 2H2O(g)
2Н2(g) + О2(g) = 2H2O(l)
из-за различия фазового состава продуктов, (а в нашем случае (g) – газовая фаза, (l) – жидкая фаза)
с позиции термодинамики различны.
В качестве параметров состояния обычно выбирают свойства системы, легко определяемые экспериментально. Параметрами состояния системы в общем случае являются, следующие независимые переменные: температура, давление, объем, энтропия, состав (или число молей n), теплота и работа, электрический заряд, площадь поверхности, внешние поля (электрическое, магнитное, гравитационное), интенсивность внешнего излучения и т. д. Соотношения, связывающие между собой эти параметры, называют уравнениями состояния системы:
f(p, V, Т, С, Се, U, Sп) = 0, (1 )
где р — давление; V — объем; Т — температура; С — концентрация компонентов системы; Се — концентрация носителей заряда; U — электростатический потенциал системы; Sп — площадь поверхности системы. В классической термодинамике рассматривают только равновесные состояния системы, т. е. такие, при которых параметры состояния не изменяются самопроизвольно во времени, а для систем, находящихся в поле внешних сил (например, в электрическом или гравитационном), закономерно изменяются от точки к точке в направлении действия поля.
Состояния системы или фазы являются неравновесными, если их параметры (р, V, Т, С, U и др.) изменяются во времени. Неравновесные состояния анализируются в термодинамике необратимых процессов.
Основные уравнения классической термодинамики можно вывести методами статистической физики (учитывая свойства отдельных молекул, составляющих ансамбль), используя математическую статистику. Этот раздел статистической физики называют статистической термодинамикой. Так как в ней определяются как термодинамические состояния, так и кинетические явления, то иобласть ее применения шире области применения классической термодинамики.
Состояние системы можно описать, не анализируя движение каждой частицы, а измеряя, например, ее температуру, объем, давление. Эти величины будут указывать на среднее значение энергии каждого атома.
Некоторые свойства (например Т и р) могут иметь вполне определенные и различные значения в каждой точке системы. Это интенсивные свойства, или интенсивные переменные. Интенсивные переменные не зависят от массы системы и могут изменяться от точки к точке или иметь одно и то же значение во всей системе. Параметры характеризующие систему как единое целое и зависящие от общего количества вещества в системе, называются экстенсивными свойствами, илиэкстенсивными переменными.К экстенсивным свойствам относятся внутренняя энергия, энтропия, свободные энергии Гиббса и Гельмгольца, энтальпия и еще ряд других.
В случае когда основными параметрами состояния выбраны температура и давление, то любое экстенсивное свойство 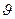 будет зависеть не только от Т и р но и от количества каждого из индивидуальных компонентов системы и соотношений меду ними:
будет зависеть не только от Т и р но и от количества каждого из индивидуальных компонентов системы и соотношений меду ними:
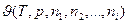 (2)
(2)
где n1, n2, …, ni – количество молей компонентов системы.
Поскольку экстенсивные величины являются однородными функциями первого порядка по отношению к числу молей и обладают свойством аддитивности, то если увеличивать в 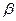 раз число частиц каждого сорта в системе, во столько же раз возрастет и значение рассматриваемого экстенсивного свойства:
раз число частиц каждого сорта в системе, во столько же раз возрастет и значение рассматриваемого экстенсивного свойства:
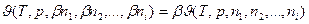 . (3)
. (3)
Частная производная
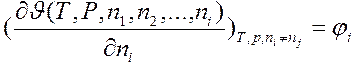 (4)
(4)
соответствует изменению экстенсивного свойства 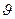 системы при добавлении к ней
системы при добавлении к ней 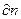 молей компонента i и называется парциальной молярной величиной. Эта ведичина характеризует скорость изменения соответствующей функции при изменении числа молей i-го компонента в условиях постоянства температуры и давления.
молей компонента i и называется парциальной молярной величиной. Эта ведичина характеризует скорость изменения соответствующей функции при изменении числа молей i-го компонента в условиях постоянства температуры и давления.
Из уравнения (4) видно, что для парциальных молярных величин справедливо следующее соотношение:
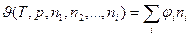 . (5)
. (5)
В дальнейшем мы увидим, что важнейшей парциальной молярной величиной является химический потенциал компонента в смеси.
При математическом описании термодинамических процессов их некоторые комбинации периодически повторяются, что будет проиллюстрировано далее.
Энергия любой термодинамической системы включает в себя следующие основные составляющие:
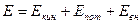 , (6)
, (6)
где 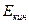 -макроскопическая кинетическая энергия системы как единого целого;
-макроскопическая кинетическая энергия системы как единого целого; 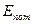 - потенциальная энергия системы во внешних силовых полях;
- потенциальная энергия системы во внешних силовых полях; 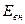 - внутренняя энергия системы. Во многих изданиях для обозначения внутренней энергии пользуются буквой U ( прошу не путать с электростатическим потенциалом системы U в формуле (1)).
- внутренняя энергия системы. Во многих изданиях для обозначения внутренней энергии пользуются буквой U ( прошу не путать с электростатическим потенциалом системы U в формуле (1)).
Величины 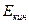 и
и 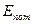 определяются так же, как и в механике.
определяются так же, как и в механике.
Внутренняя энергия 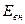 зависит от состояния системы и является функцией ее термодинамических параметров.
зависит от состояния системы и является функцией ее термодинамических параметров.
По определению Р. Клазиуса, внутренняя энергия – это сумма всех видов энегий, которыми обладает система.
В соответствии с характером движения частиц внутри системы основными составляющими внутренней энергии являются энергия массы, кинетическая, вращательная и колебательные энергии частиц, энергия межмолекулярного и внутримолекулярного взаимодействий и др.
На значение внутренней энергии не влияют внешние факторы: перемещение системы в пространстве под действием внешних сил и потенциальная энергия пространственного расположения ее во внешнем силовом поле.
Можно отметить, что абсолютное значение внутренней энергии любой произвольно взятой системы неизвестно и практически не поддается расчету вследствие неопределенности начала отсчета, для которого 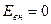 . Однако в термодинамике это значение не существенно, а важно лишь изменение
. Однако в термодинамике это значение не существенно, а важно лишь изменение 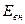 при переходе системы из одного состояния в другое.
при переходе системы из одного состояния в другое.
Внутренняя энергия это сумма средних значений энергий, составляющих систему частиц. Следовательно, она не зависит от промежуточных стадий процесса, а определяется только конечным и начальным состояниями системы и относится к функциям состояния.
Функция состояния – это функция, изменение которой определяется только конечным и начальными состояниями системы и не зависит от пути перехода.
Следовательно, при переходе системы из состояния 1 в состояние 2 изменение ее внутренней энергии можно записать в виде
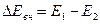 , (7)
, (7)
где 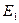 ,
, 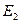 - значения внутренней энергии системы соответственно в начальном и конечном состояниях.
- значения внутренней энергии системы соответственно в начальном и конечном состояниях.
Основные соотношения между параметрами термодинамических систем описываются двумя законами термодинамики.
Первый закон термодинамики (первое начало термодинамики), являясь законом сохранения энергии, определяет взаимосвязь между теплотой Q, поглощенной системой, ее внутренней энергией Евн и работой А, совершаемой системой: при отсутствии материального обмена частицами с внешней средой тепловая энергия, получаемая системой, расходуется на приращение внутренней энергии и совершение работы против сил внешнего давления
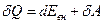 (8) (2)
(8) (2)
Внутренняя энергия 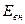 является функцией состояния, тогда как подводимая (отводимая) к системе теплота Q и совершаемая работа А не являются таковыми, поскольку зависят от пути перехода системы из состояния с энергией
является функцией состояния, тогда как подводимая (отводимая) к системе теплота Q и совершаемая работа А не являются таковыми, поскольку зависят от пути перехода системы из состояния с энергией 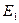 в состояние с энергией
в состояние с энергией 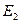 .
.
В этом уравнении бесконечно малые изменения работы и теплоты обозначают через δ, так как 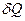 и
и 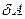 не являются полными дифференциалами в отличие от приращения внутренней энергии dEBH. Это лишний раз подчеркивает, что в отличие от Евн теплота и работа характеризуют не системы, а процессы, заключающиеся в передаче энергии в той или иной форме.
не являются полными дифференциалами в отличие от приращения внутренней энергии dEBH. Это лишний раз подчеркивает, что в отличие от Евн теплота и работа характеризуют не системы, а процессы, заключающиеся в передаче энергии в той или иной форме.
В общем случае в (8) должны присутствовать составляющие, учитывающие не только работу, совершаемую по преодолению сил внешнего давления, но и работу, совершаемую против всех остальных сил (электрических, магнитных, и др.), которую принято называть полезной. Тогда для бесконечно малого изменения состояния системы уравнение первого начала термодинамикри примет вид
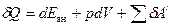 , (9)
, (9)
где 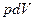 - работа по преодолению внешнего давления (работа расширения);
- работа по преодолению внешнего давления (работа расширения); 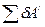 - полезная работа против сторонних сил.
- полезная работа против сторонних сил.
Если внутренняя энергия определяется состоянием системы и ее изменение не зависит от характера процесса, т. е. от пути перехода из одного состояния в другое, то теплота и работа зависят от способа или формы передачи энергии и их значения зависят от характера процесса. Например, бесконечно малое расширение газа в цилиндре производит работу
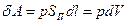 (10) (3)
(10) (3)
где р— давление газа; SП — площадь поперечного сечения цилиндра; dl — бесконечно малое перемещение поршня; dV — приращение объема газа.
Суммарная работа расширения

(11) (4)
В координатах р — V работа определяется площадью под кривой p=f(V), согласно которой система из состояния V1 переходит в состояние V2.
Работа равновесного процесса
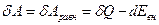 (12) (5)
(12) (5)
Эта работа максимальна, так как она больше работы любого неравновесного процесса, для которого δA<δQ-dEвн. Поскольку значения δQ и dЕвн равновесного процесса не зависят от пути перехода системы из одного состояния в другое, а определяются только начальным и конечным состояниями системы, и максимальная работа также не зависит от пути перехода и определяется лишь начальным и конечным состояниями системы, т. е. является полным дифференциалом.
Второй закон термодинамики вводит новую функцию для описания системы - энтропию. Математически энтропию можно представить как:
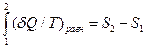 |
(13) (6)
Или
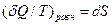 (14)
(14)
где ( 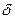 Q/T)равн— элементарная приведенная теплота в равновесном1 процессе; S2—S1— приращение некоторой функции состояния системы; dS— дифференциал функции состояния.
Q/T)равн— элементарная приведенная теплота в равновесном1 процессе; S2—S1— приращение некоторой функции состояния системы; dS— дифференциал функции состояния.
Таким образом, интеграл элементарных приведенных теплот в равновесном процессе равен приращению некоторой функции состояния системы, а подынтегральное выражение — дифференциалу этой функции.
Итак, энтропия есть функция состояния системы, изменение которой равно сумме приведенных теплот, поглощенных системой в равновесном процессе. Энтропия является однозначной, непрерывной и конечной функцией состояния. Ее выражают в Дж/(К*моль). . Эта единица называется энтропийной единицей.
Перепишем уравнение (12) следующим образом:
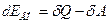 (15)
(15)
Подставив 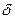 А из (10) в (15), получим
А из (10) в (15), получим
dEm= 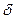 Q-pdV. (16)
Q-pdV. (16)
Тогда с учетом (14) выражение (16) примет вид
dEBH = TdS — pdV (17)
Таким образом, внутренняя энергия системы может изменяться за счет совершения работы и обмена теплотой.
Для механической системы при стремлении к равновесию характерно освобождение потенциальной энергии и переход ее в работу, совершаемую над средой. Аналогично этому термодинамическая система при стремлении к равновесию также высвобождает частьвнутренней энергии, которая может передаваться среде в виде теплоты или работы. Эту составляющую внутренней энергии называют свободной энергией G.
Свободную энергию термодинамической системы, так же как и внутреннюю, можно разбить на тепловую и потенциальную составляющие. Тепловая составляющая зависит от степени упорядоченности теплового движения частиц, а потенциальная определяется силовым взаимодействием атомов без учета их теплового движения. Взаимосвязь между тепловой и потенциальной составляющими свободной энергии лежит в основе ряда физических явлений и превращений.
Так как изменение свободной энергии определяется только разностью состояний системы и не зависит от пути перехода из одного состояния в другое, то оно является полным дифференциалом от параметров состояния системы:
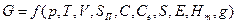 |
где E — электрический потенциал; Нт—магнитный потенциалу g — гравитационный потенциал.
Для упрощения записи обозначим параметры состояния следующим образом:
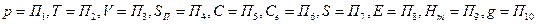
Если параметры состояния термодинамической системы известны, то систему можно описать уравнением вида
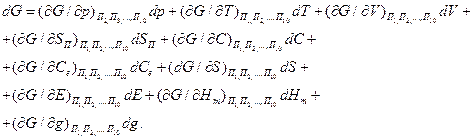 |
(18)
Так как 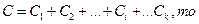
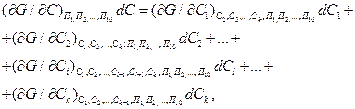
где k — число компонентов.
Члены уравнения (18) могут быть представлены в виде
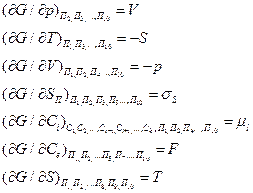 |
(19)
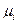 и т. д.
и т. д.
где 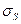 — поверхностная энергия; — химический потенциал i-гo компонента; F — уровень Ферми.
— поверхностная энергия; — химический потенциал i-гo компонента; F — уровень Ферми.
В общем случае движущей силой процесса является градиент свободной энергии по тому параметру состояния П, который переносится в процессе. Поэтому dG/дПназывают параметрическим потенциалом и обозначают Пi. Если П — концентрация компонента i,то Пi— его химический потенциал 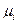 ; если П— площадь поверхности, то Пi— поверхностная энергия и т. д.
; если П— площадь поверхности, то Пi— поверхностная энергия и т. д.
В дальнейшем рассмотрим отдельные составляющие уравнения (19),способы их определения расчетным или экспериментальным путем, а также их вклад в физико-технологические характеристики процессов, используемых при изготовлении ЭС.
Далеко не для всех технологических систем нужно знать все параметры состояния. Достаточно знать лишь те из них, которые оказывают существенное влияние на изменение свободной энергии данного процесса. Если для конкретной термодинамической системы некоторые параметры состояния можно признать незначащими, то уравнение (18)можно значительно упростить. Так, в отсутствие электрического, магнитного и гравитационного полей изменение свободной энергии
dG = Vdp - SdT - pdV + TdS. (20)
Часть свободной энергии системы, которая может превращаться в работу, является функцией состояния системы:
dGH = -SdT - pdV. (14)
Функцию GH называют свободной энергией Гельмгольца.
Аналогично, когда кроме работы расширения имеют место другие виды работы, соответствующую функцию состояния можно записать как
dGG = -SdT +Vdp. (15)
Функцию GGназывают свободной энергией Гиббса. При вычислении свободной энергии часто используют функцию состояния, называемую теплосодержанием или энтальпией:
dH = TdS+Vdp. (16)
Эта функция Нчисленно равна количеству теплоты, выделяемой или поглощаемой системой в данном процессе при постоянном давлении.
Связь между свободной энергией Гельмгольца и внутренней энергией определяется уравнением
GH=Eвн-TS, (17)
связь между свободной энергией Гиббса и энтальпией — уравнением
Gg= H-TS. (18)
Однако в выражениях (17)и (18)связь между указанными величинами не является явной, поскольку в них входит энтропия S,которая является термодинамической функцией состояния.
Подставив соотношения
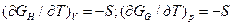 (19)
(19)
в (17) и (18), получим
GH = EBН + T(дGH/dT)v; (20)
GQ=H +T(дGG/dT)p. (21)
Уравнения (20) и (21) называют уравнениями Гиббса — Гельмгольца. Они имеют важное значение в практике термодинамических расчетов. Приведенные функции состояния (Евн, GH, GG, Н),через производные которых просто и в явном виде могут быть выражены все термодинамические свойства системы, называют характеристическими функциями или термодинамическими потенциалами.
Из соотношений (10), (14) — (16) следует, что систему могут характеризовать не только функции Евн, GH, GG, Н,но и параметры состояния Т, р, S, V,если их выразить через характеристические функции, например, T=f(GH, V);p=f(GG, Т);S =f(H,р); V=f(Еbh,S).Этот вывод важен для инженерной практики, так как позволяет пользоваться для анализа и расчета процессов привычными величинами: р, V, Ти S.
Дата добавления: 2015-08-21; просмотров: 1492;
