В-клеточный, или гуморальный иммунный ответ.
Первый из них регулируется Т-хелперами типа 1и приводит к формированию 1) эффекторных CD4+ Т-клеток воспаления и 2) цито-токсических CD8+ Т-лимфоцитов, а также соответствующих им Т-клеток памяти. Второй путь регулируется Т-хелперами типа 2и заканчивается образованием плазматических клеток (продуцентов антител классов М, G, А и Е) и В-лим-фоцитов памяти. Переключение на синтез некоторых изотипов антител частично контролируется Т-хелперами типа 1. За исключением скрытого индуктивного периода, иммунный ответ в среднем продолжается около 3 нед с максимальным напряжением на 1-й нед.
Можно выделить несколько основных стадий иммунного ответа:
1.Эндоцитоз антигена, его процессинг и загрузка на молекулы HLA I или HLA II для презентации лимфоцитам.
2. Распознавание комплекса антигенный пеп-тид/HLA I или HLA II и других стимулов.
3. Сигнальная трансдукция и активация клеточного клона.
4. Клональная экспансия, или пролиферация.
5. Созревание эффекторных клеток и клеток памяти.
6. Эффекторная активность.
Антигенпредставляющая клетка (макрофаг,
дендритная клетка или В-лимфоцит) сталкивается с нативным антигеном и эндоцитирует его. Макрофаги фагоцитируют главным образом па-
Часть I. ОБЩАЯ НОЗОЛОГИЯ
тогены (болезнетворные факторы бактериального происхождения), для которых характерно внутриклеточное паразйтирование (вирусы, бактерии, грибы, простейшие и др.); дендритные клетки пиноцитируют вирусы; В-клетки интер-нализируют различные токсины. Следующее событие - процессинг,который представляет собой ферментативный катализ макромолекулы антигена внутри антигенпредставляющей клетки. В результате процессинга происходит высвобождение доминирующей антигенной детерминанты (иммуноактивного пептида, или суперан-гигена), которая загружается на желобки собственных молекул HLA I или HLA II класса, выводится на поверхность клетки для представления (presentation) лимфоцитам. В зависимости от происхождения антигена выделяют два пути процессинга.
Экзогенные антигеныпрезентируются в комплексе с молекулами HLA II наивным CD4 + + Т-клеткам (путь, опосредуемый HLA И).Сначала эти антигены эндоцитируются и фраг-ментируются с помощью протеолитических ферментов в эндосомах (лизосомах). В то же самое время молекулы HLA II, связанные с шаперона-ми (калнексином и инвариантной цепью Ii), синтезируются и собираются в эндоплазматическом ретикулуме. Ii-цепь необходима для защиты желобка молекулы HLA вплоть то того момента, пока сюда не будет загружен антигенный пептид. Затем комплекс HLA Il/li-цепь транспортируется через аппарат Гольджи в эндосомы, где Ii-цепь теряется, а роль по защите желобка начинают выполнять дополнительные молекулы HLA-DM и, вероятно, HLA-DO. Наконец, антигенный пептид загружается на желобок молекулы HLA II, и этот комплекс экспрессируется на поверхности клетки.
Эндогенные,или внутриклеточно расположенные, антигены микробного происхождениязагружаются на молекулы HLA I (путь, опосредуемый HLAI) для представления наивным CD8+ Т-клеткам. Сначала в отличие от экзогенных антигенов такие цитоплазматические антигены перемещаются в цитозоль, где они расщепляются в крупном протеолитическом комплексе - протеасоме. После этого антигенный пептид транспортируется через «туннель» молекул TAP-l/TAP-2 в эндоплазматический ретикулум. Одновременно здесь происходит сборка молекулы HLA I, желобок которой (по аналогии с
Ii-цепью у HLA II) находится «под защитой» ша-перонов (сначала калнексина, затем кальрети-кулина), а укладка всей молекулы HLA I в последующем стабилизируется дополнительными молекулами (тапазином и др.). После загрузки антигенного пептида на желобок HLAI этот комплекс транспортируется на поверхность клетки.
Небелковые антигены,вероятно, загружаются на не-HLA антигенпредставляющие молекулы CD1.
В целом макрофаги и В-клетки вовлечены соответственно в Т-клеточный, или гуморальный, иммунный ответ по пути, опосредованному HLA II, а дендритные клетки двух типов способны к перекрёстной презентации. Дендритная клетка типа 1 осуществляет процессинг эндогенных антигенов по пути с HLA I для запуска Т-кле-точного ответа, а дендритная клетка типа 2 про-цессирует экзогенные антигены по пути с HLA II и включает В-клеточный ответ.
Распознаваниепротекает в течение нескольких часов. Однако при нарушениях клеточной миграции и межклеточных взаимодействий оно может быть более длительным. Возможно, это приводит к замедлению всего иммунного ответа на патоген. Клиническими проявлениями этой стадии являются повышение температуры тела, мышечная слабость, снижение аппетита и сонливость. По большей части они обусловлены системными эффектами цитокинов, о чём будет более подробно рассказано далее.
Для того чтобы мог стартовать специфический иммунный ответ на конкретный антиген, необходима встреча Т- и В-лимфоцитов соответствующего клона с антигенпредставляющей клеткой. Некоторые антигены бактерий (Т-незави-симые антигены) распознаются с помощью BCR В-клеток и не требуют помощи со стороны Т-хелперов. Большинство нативных антигенов (так называемых Т-зависимых антигенов) распознаётся по «полной программе» наивными CD4+ Т-хелперами типа 1 и CD8+ Т-клетками (для включения Т-клеточного ответа, или пути Т-хелперов 1),а также наивными CD4 + Т-хелперами типа 2 (для включения гуморального ответа, или пути Т-хелперов 2).Интересно, что для прайминга CD8+ Т-клеток необходимо участие CD4+ Т-хелперов 1.
Во время распознавания лимфоциты воспринимают три типа обязательных сигналов - один специфический и два неспецифических:
Глава б / РОЛЬ ИММУННОЙ СИСТЕМЫ В ПАТОЛОГИИ
Костимулирующие молекулы при иммунном ответе
Таблица 23
| Клетки | Молекула | Функция |
| Антигенпредставляющие клетки | В7.1.В7.2 | Лиганды для CD28, CTLA-4 |
| Т-хелпер 1 | CD28 CTLA-4(CD152) | Активационный сигнал Ингибирующий сигнал |
| Т-хелпер 2 | OX40L | Активационный сигнал |
| В-лимфоцит | CD40 CD22 | Активационный сигнал на переключение синтеза различных классов антител Ингибирующий сигнал |
1) антигенный пептид/HLA I или HLA II;
2) цитокины;
3) костимулирующие молекулы. Антигенный пептид, загружаемый на HLA I
или HLA II в результате процессинга, служит специфическим сигналом. Это одновременное «двойное» распознавание «своего» (белков HLA) и «несвоего» (чужого антигена) было открыто лауреатами Нобелевской премии (1996) Р.С. Doherty (Австралия, США) и R.M. Zinkernagel (Швейцария) и оказалось довольно универсальным явлением. Секретируемые цитокины и экс-прессируемые костимулирующие молекулы являются двумя обязательными неспецифическими сигналами. Более того, для обеспечения надёжного физического контакта клеток необходимо также взаимодействие таких адгезивных молекул, как LFA-1, ICAM-1, ICAM-2, ICAM-3. Цитокины играют одну из главных ролей в неспецифической регуляции иммунного ответа. Т- и В-лимфоциты получают цитокиновые сигналы от антигенпредставляющих клеток, NK-клеток, тучных клеток и др. Обратный сигнал от лимфоцитов, например секретируемый ИФНу, способствует реэкспрессии HLA I/ HLA II на антигенпредставляющих клетках. Цитокины, действующие на ранних стадиях иммунного ответа, могут быть разделены на две группы в зависимости от его направления:
1. ИЛ-2, ИЛ-12, ИЛ-18, ИФН-у, ФНОа/р (для
пути Т-хелперов типа 1).
2. ИЛ-4 (для пути Т-хелперов типа 2).
Однако на следующих стадиях иммунного
ответа (клональная экспансия, созревание эффекторов, переключение синтеза изотипов антител) в процесс вовлекаются другие цитокины.
Костимулирующие молекулы также играют важную роль в неспецифической регуляции иммунного ответа (табл. 23).
Активация клеток является результатом сигнальной трансдукции, которая осуществляется серией сложных внутриклеточных реакций. После распознавания первоначально наблюдается активация связанных с корецепторами и молекулами CD3 (на Т-клетках) или CD79 (на В-клет-ках) тирозинкиназ нескольких семейств (Lck, Fyn, Blk, Btk, Lyn, Zap70, Syk и др.), затем через посредничество адаптерных белков включаются сигнальные пути. Один из них связан с активацией фосфолипазы Су, образованием инозитолтрифосфата и диацилглицерола, активацией протеинкиназы С и мобилизацией внутриклеточного Са2\ транскрипцией гена ИЛ-2. Данный цитокин является ключевым ростовым фактором для лимфоцитов при иммунном ответе. Второй сигнальный путь связан с обменом арахидоновой кислоты и приводит к транскрипции генов структурных белков, необходимых для осуществления митозов клеток.
Клональная экспансия лимфоцитов представляет собой их бурную пролиферацию, которая протекает в периферических органах иммунной системы. Пролиферирующие В-лимфоциты образуют вторичные фолликулы в лимфатических узлах (центробластная стадия), при этом размножение клеток регулируется рядом цитоки-нов: ИЛ-2, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-10, ИЛ-13, ИЛ-14, ИФН-у, ФНО и др. В последующем цен-тробласты начинают превращаться в центроци-ты, которые мигрируют на периферию фолликулов (центроцитарная стадия). В этот момент клетки вступают в период соматических гипермутаций, который является своеобразным способом селекции нужной специфичности BCR. Происходит позитивный отбор клеток с высокоспецифичным BCR и негативный отбор В-лим-фоцитов с низкоспецифичным рецептором. В процессе созревания В-клетки претерпевают
Часть I. ОБЩАЯ НОЗОЛОГИЯ
морфологические изменения (иммунобласт, затем лимфоплазмоидная клетка и, наконец, плаз-моцит) и мигрируют в костный мозг и MALT для синтеза антител различных классов. Синтез ранних антител IgM наблюдается уже к концу первых суток клинического инфекционного эпизода, а высокоспецифических IgG - на 5-7-е сут.
Клональная экспансия и созревание Т-клеток протекают в паракортикальных зонах лимфатических узлов и периартериолярных пространствах селезёнки. Распознавшие антиген клетки вступают в пролиферацию и превращаются в лимфобласты. Клоны CD8+ Т-клеток нарастают быстро, а клоны CD4+ Т-лимфоцитов - более медленно. В целом клональная экспансия и диф-ференцировка регулируются разными цитокина-ми (ИЛ-2, ИЛ-7, ИЛ-9, ИЛ-12, ИЛ-15, ИФН-у, ФНО и др.) и адгезивными молекулами. В процессе дифференцировки значительно изменяется фенотип Т-лимфоцитов, но в отличие от В-лим-фоцитов они не меняются морфологически.
Характерным клиническим эквивалентом стадий клональной экспансии и дифференцировки является увеличение периферических лимфатических узлов, миндалин, видимых лимфатических фолликулов и селезёнки. Можно наблюдать эти симптомы при респираторной, урогениталь-ной или значительной системной инфекциях.
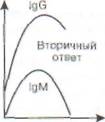
|
По окончании иммунного ответа наряду с эф-фекторными клетками формируются Т- и В-клет-ки памяти. В отличие от небольших сроков жизни, характерных для эффекторных лимфоцитов,

Рис. 38. Первичный и вторичный гуморальный
ответ. В первом случае нарастание IgG отстает от
нарастания IgM, при этом, поскольку IgM является
низкоспецифичным по отношению к патогену, отмечаются все симптомы инфекционного заболевания (выделено серым). При вторичном ответе патоген связывается сразу высокоспецифичными антителами класса IgG, поэтому клинических проявлений болезни нет. По горизонтали - время (сут); по вертикали - содержание иммуноглобулинов (г/л)
клетки памяти остаются жизнеспособными в течение длительного времени (пожизненно). Существуют CD4+- и CD8+ Т-клетки памяти, В-клет-ки памяти и долгоживущие плазматические клетки. В отличие от наивных Т-лимфоцитов Т-клетки памяти характеризуются фенотипом CD45RO+, CD44hi, быстрым HLA-независимым циклом и способностью секретировать большие количества цитокинов. Долгоживущие плазматические клетки обеспечивают дополнительный механизм поддержания синтеза иммуноглобулинов без дополнительной антигенной стимуляции в течение 1,5 лет.
Вторичный иммунный ответ протекает в ускоренном режиме за счёт клеток памяти (рис. 38). Появление IgM в сыворотке крови часто указывает на свежую инфекцию или реактивацию персистирующего патогена, а синтез IgG соответствует наличию иммунной памяти к однажды перенесённой инфекции. При таком ускоренном синтезе IgG клинические проявления инфекционной болезни обычно отсутствуют.
6.2.2. Эффекторные реакции
Физические барьеры (кожа, слизистые оболочки с их мерцательным эпителием, секреты) являются первой линией защиты, часто очень эффективной. Многие патогены могут быть уничтожены с помощью лизоцима, бактерицидных жирных кислот,р-дефензина, кислотностижелудочного сока и др. Печень представляет собой метаболический барьер для патогенов за счёт моноксигеназной системы (цитохром Р450).
У здоровых людей в сыворотке крови постоянно присутствуют неспецифические натуральные антитела, представляющие собой IgM, которые направлены против антигенов условнопа-тогенной флоры. Существуют также каталитические антитела, обладающие протеиназной и нуклеазной активностью.
Система естественной цитотоксичности (NK-клетки и интерфероны)обеспечивает экстренную защиту против вирусов и других внутриклеточных патогенов без воспалительной реакции. NK-клетки подвергают апоптозу любую клетку в организме, если она не экспрессирует на своей поверхности HLA I, поэтому мишенями для них являются собственные клетки, инфицированные вирусами, опухолевые, деградирующие и повреждённые клетки. Распознав HLA I
Глава 6 / РОЛЬ ИММУННОЙ СИСТЕМЫ В ПАТОЛОГИИ
Типыспецифических эффекторных механизмов
Таблица 24

 Опосредуемые В-клетками
Опосредуемые В-клетками
Опосредуемые Т-клетками
 1. Связывание антигена в иммунные комплексы и его:
1. Связывание антигена в иммунные комплексы и его:
а) простая нейтрализация;
б) деградация в связи с активацией
комплемента по классическому пути;
в) опсонизация антителами IgM/IgG и
последующий фагоцитоз
2. Антителозависимая клеточная цитотоксичность (АЗКЦ), например при отторжении трансплантата
1. Апоптоз клеток-мишеней, индуцированный CD8+ цитотоксическими Т-клетками
2. Деградация антигена путем индуцированного CD4+ Т-эффекторами иммунного воспаления (ГЗТ) с активацией макрофагов и других клеток
на какой-либо встретившейся клетке, NK-клет-ка, напротив, получает ингибирующий сигнал и не индуцирует апоптоз этой клетки.
При попадании патогенов в ткань быстро развивается неспецифическое воспаление. Этот процесс включает острофазную реакциюбелков сыворотки крови, активацию комплементапо альтернативному пути и неспецифический фагоцитознейтрофилами и макрофагами. Такое воспаление является острым, не зависит от присутствия антител и сопровождается активацией эндотелия.
Если патогену удаётся миновать неспецифический эшелон защиты, на него развивается иммунный ответ, следствием которого является включение специфических эффекторных механизмов, направленных на деструкцию данного патогена (табл. 24). Следует иметь в виду, что иммунное воспаление типа IV (по Gell и Coombs) с иммунологической точки зрения является нормальной эффекторной реакцией на внутрикле-точно расположенные патогены. Однако нерегулируемое иммунное воспаление с широким распространением на собственные ткани является безусловным патологическим явлением.
6.2.3. Регуляция иммунных
процессов
Иммунный ответ является хорошо регулируемым процессом. Регуляция имеет большое значение для достижения нужного уровня специфичности и иммунной памяти, включения именно тех эффекторных механизмов, которые бы наилучшим образом отвечали потребностям организма, а также для исключения нежелательных последствий гиперактивации иммунной системы
(например, при чрезмерном иммунном воспалении, аллергиях и аутоиммунных расстройствах).
Регуляция иммунных процессов осуществляется с помощью механизмов иммунного самоконтроля за счёт влияния печени, эндокринной системы, ЦНС и в связи с генетическими механизмами контроля. Система иммунной саморегуляции включает принцип отрицательной обратной связи, идиотип-антиидиотипическую сеть, баланс Тх1/Тх2, цитокиновую регуляцию, контроль со стороны костимулирующих молекул и др. Одну из значимых ролей играют регуля-торные Т-лимфоциты, которые функционируют, имея разные цитокиновые профили (табл. 25).
Печень является главным образом источником иммуносупрессивных факторов (а-фетопро-теин, «pit» NK-клетки и др.). Гормоны оказывают дозозависимые разнонаправленные эффекты в отношении иммунных процессов. В физиологических концентрациях СТГ, ТТГ, тироксин, трийодтиронин, инсулин, пролактин стимулируют иммунный ответ, а АКТГ, глюкокортикоиды иполовые гормоны - супрессируют. В последние годы интенсивно исследуется влияние на иммунную систему гормона эпифиза мелатоиина, который, наряду с иммуностимулирующим действием, имеет также ритморегулирующий, снотворный, антиоксидантный и другие эффекты. ЦНС влияет на иммунную систему через посредничество нейротрансмиттерных (допамин-, серо-тонин-, ГАБА- и пептидэргических) рецепторов, проявляя стереотипную координацию иммунных процессов, связывая их с разными сферами психоэмоциональной деятельности мозга.
Генетическая регуляция иммунитета позволяет обеспечивать многообразие антигенраспоз-нающих рецепторов за счёт генных реаранжи-
Часть I. ОБЩАЯ НОЗОЛОГИЯ
Регуляторные субпопуляции Т-лимфоцитов
Таблица 25
| Субпопуляция | Цитокиновый профиль | Основные функции |
| Т-хелпер 1 | ИЛ-2, ИФНу, ФНОр | Регуляция Т-клеточного и гуморального ответа (переключение на синтез lgG2, lgG3, IgA), активация макрофагов |
| Т-хелпер 2 | ИЛ-4. ИЛ-5, ИЛ-6, ИЛ-10, ИЛ-13,ТРФ-[) | Регуляция гуморального ответа, включая переключение на синтез антител IgE, IgC,, |
| Т-хелпер 3 | ТРФ-р | Функции, сходные с Тх2; толерантность при беременности (?) |
| Т-регулятор 1 | ИЛ-10, ТРФ-р, ИФН-у | ? |
ровок в хромосомах 2, 7, 14 и 22 не только в эмбриональном периоде, но и непосредственно в ходе иммунного ответа. Дополнительное разнообразие синтезируемых антител достигается также в связи с соматическими гипермутациями. Индивидуальная сила иммунного ответа регулируется индивидуальным набором HLA-генов (6-я хромосома), белковые продукты которых способны с разной эффективностью загружать различные антигенные пептиды.
6.3. ИММУНОДЕФИЦИТНЫЕ СОСТОЯНИЯ
Иммунодефициты - это состояния, при которых отмечается выпадение одного или нескольких компонентов иммунной системы, что проявляется снижением резистентности к экзогенным (внеэпидемическим) иэндогенным (услов-нопатогенным) инфекциям. Присутствие инфекционного синдрома в форме острых гипертоксических или повторных, рецидивирующих, затяжных и хронических инфекционных процессов является преобладающим, но не единственным синдромом, характерным для иммунодефицитов. Другими проявлениями могут быть разнообразные аллергические реакции, аутоиммунные расстройства и даже пролиферативные процессы (в доброкачественном варианте - лимфаденопатии, гипертрофия миндалин, тимомегалия, в злокачественном - развитие лимфом, лимфосарком и
ДР-)-
Иммунодефициты подразделяются по происхождению - на первичныеи вторичные,по клинической выраженности - на манифестныеи
Минорные,по локализации дефекта - на дефициты антител, Т-лимфоцитов, комбинированные дефициты Т- и В-клеток, дефекты NK-кле-ток, фагоцитоза, дефициты адгезивных молекул, комплемента.
Первичные иммунодефициты обусловлены дефектами в отдельном гене или целых кластерах генов, ответственных за синтез белковых молекул иммунной системы. Манифестные формы первичных иммунодефицитных состояний проявляются тяжёлыми разнообразными инфекциями, которые развиваются с раннего возраста и часто (без адекватной терапии) приводят к летальному исходу, но встречаются такие формы редко (1 случай на 100 000 новорождённых). Однако если рассмотреть проблему более широко, с учётом слабо диагностируемых минорных форм, и принять во внимание неустойчивость равновесия популяционных наборов HLA и наиболее часто встречающихся патогенов в среде обитания данной популяции (от чего зависит сила иммунного ответа), то можно констатировать, что по большей части все иммунодефициты - первичные. Классическими примерами манифестных первичных иммунодефицитов являются болезнь Брутона (Х-сцепленная агаммаглобулине-мия, обусловленная дефектом гена, который кодирует тирозинкиназу Btk), синдром Луи-Бар, или атаксия-телеангиэктазия (дефицит Т-лимфоцитов, связанный с аномалией одного из генов в 11-й хромосоме), хроническая грануломатозная болезнь (отсутствие «респираторного взрыва» в фагоцитирующих нейтрофилах из-за аномалий генов в 1, 7, 16-й или Х-хромосомах).
Вторичные иммунодефицитыобусловлены количественным и качественным голоданием
Глава б / РОЛЬ ИММУННОЙ СИСТЕМЫ В ПАТОЛОГИИ
(недостатком белков, витаминов, микроэлементов Fe, Zn, Си и др.), эндокринопатиями (сахарный диабет, болезнь Иценко-Кушинга), потерей иммунокомпетентных клеток и молекул при травмах, кровотечениях, операциях, ожоговой болезни, утрате органов иммунной системы, воздействием ионизирующей радиации, полихимиотерапии, гипертоксическими инфекциями и инфекциями, к которым иммунная система человека оказалась эволюционно не готовой (ВИЧ и др.).
Синдром приобретённого иммунодефицита (СПИД) является классическим примером такой инфекции. Возбудитель болезни, ВИЧ, имеет избирательное сродство одного из своих оболо-чечных белков (gpl20) к молекуле CD4, которая экспрессируется Т-лимфоцитами-хелперами. При СПИДе наблюдается последовательное выключение Т-клеточного иммунитета, что приводит к активации оппортунистических инфекций и другим расстройствам со стороны иммунной системы, включая развитие опухолевого процесса (саркома Капоши).
Диагностика иммунодефицитных состояний основывается на клинико-иммунологических исследованиях. Л.В. Ковальчук и соавт. (1980) предложили двухуровневое проведение лабораторных исследований иммунного статуса. 1-й (скрининговый) уровень включает общий анализ крови, определение IgM, IgG, IgA, розетко-образующих клеток для оценки Т- иВ-лимфо-цитов (этот метод в настоящее время имеет историческое значение), тест на фагоцитоз (например, НСТ-тест). 1-й уровень позволяет выявлять грубые дефекты в иммунной системе и планировать дальнейшие исследования 2-го уровня (CD-маркеры, продукция цитокинов, специфических антител и аутоантител, пролиферативная способность клеток, белки комплемента, «острой фазы» ит.д.). Исследования 2-го (аналитического) уровня требуют развёртывания современной иммунологической лаборатории (с проточным цитофлюориметром, ламинарным боксом для культивирования тканей и т.д.), наличия высококвалифицированного персонала; эти анализы позволяют выявлять тонкие нарушения в функционировании иммунной системы и проводить современные научные исследования.
Перспективы лечения иммунодефицитных состояний связаны с замещением недостающих компонентов (введение иммуноглобулинов, пе-
ресадка костного мозга и т.д.), назначением им-мунотропных препаратов (при минорных формах) и генной терапией.
6.4. АУТОИММУННЫЕ РАССТРОЙСТВА
В норме в каждом организме присутствуют антитела, В- и Т-лимфоциты, направленные против антигенов собственных тканей (аутоантиге-нов). Аутоантигены подразделяются на обычные(к ним относится самый широкий набор белков и других макромолекул, и в которых построен человеческий организм), «секвестрированные»(они присутствуют в тканях, обычно не доступных для лимфоцитов, таких как мозг, передняя камера глаза, половые железы) и модифицированные(т.е. образующиеся при повреждениях, мутациях, опухолевом перерождении). Следует также отметить, что некоторые антигены (например, белки миокарда и почечных клубочков) являются перекрёстно реагирующимипо отношению к некоторым микробным антигенам (в частности, Р-гемолитического стрептококка). Исследование аутоантител, направленных против аутоантигенов, позволило разделить их на три группы:
- естественные, или физиологические(их большинство, они не могут при взаимодействии с аутоантигенами повреждать собственные ткани);
- антитела-«свидетели»(они соответствуют иммунологической памяти в отношении аутоантигенов, которые когда-либо образовывались вследствие случайных повреждений тканей);
- агрессивные, или патогенные(они способны в условиях эксперимента вызывать повреждение тканей, против которых направлены).
Само по себе наличие аутоантигенов, большинства аутоантител и аутореагирующих лимфоцитов не является патологическим явлением. Однако при наличии ряда дополнительных условий может запускаться и постоянно поддерживаться аутоиммунный процесс, который способствует развитию иммунного воспаления с деструкцией вовлечённых тканей, формированием фиброза и новообразованием сосудов, что в конечном счёте приводит к утрате функции соответствующего органа. Важнейшими дополнительными условиями включения и поддержания аутоиммунного процесса являются:
Часть I. ОБЩАЯ НОЗОЛОГИЯ
- хронические вирусные, прионовые и другие инфекции;
- проникновение возбудителей с перекрёстно реагирующими антигенами;
- наследственные или приобретённые молекулярные аномалии строения важнейших структурных и регуляторных молекул иммунной системы (включая молекулы, вовлечённые в контроль апоптоза);
- индивидуальные особенности конституции и обмена веществ, предрасполагающие к вялотекущему характеру воспаления;
- пожилой возраст.
Условно патогенез аутоиммунных расстройств можно разделить на два этапа - индуктивный и эффекторный.
Индуктивный этап тесно связан со срывом иммунологической толерантности. Толерантность к собственным антигенам организма является естественным состоянием, при котором деструктивная активность иммунной системы направлена только на внешние антигены. Процессы старения организма с иммунологической точки зрения обусловлены медленной отменой такой толерантности.
Имеется несколько механизмов, контролирующих поддержание долгосрочной аутотолерант-ности:
1. Клональная делеция.
2. Клональная анергия.
3. Иммуносупрессия, опосредованная Т-клет-ками.
Клональная делеция является формой центральной толерантности, которая формируется в ходе негативной селекции в тимусе и костном мозге и достигается апоптозом Т- и В-лимфоци-тов, имеющих высокоспецифические антигенраспознающие рецепторы к аутоантигенам. Клональная анергия - также форма центральной толерантности, которая характерна главным образом для В-клеток, имеющих рецепторы (BCR) к растворённым аутоантигенам в низких концентрациях. При клональной анергии клетки не погибают, а становятся функционально неактивными.
Однако некоторые Т- и В-лимфоциты нередко избегают негативной селекции и при наличии дополнительных условий могут активироваться. Этому могут способствовать проникновение патогенов с перекрёстными антигенами или поликлональными активаторами, сильный сдвиг
Глава 6 / РОЛЬ ИММУННОЙ СИСТЕМЫ В ПАТОЛО
цитокинового профиля в сторону Txl, затяжной воспалительный процесс с наличием множества медиаторов, которые могут модифицировать ауто-антигены в очаге и др. Для сохранения толерантности периферические аутореактивные Т-лим-фоциты должны быть подвержены апоптозу или стать энергичными под супрессивным влиянием цитокинов профиля Тх2. Если не происходит включения механизмов периферической толерантности, т.е. иммуносупрессии, опосредуемой Т-клетками, начинается развитие аутоиммунных расстройств. В значительной степени аутоиммунная патология (как и опухолевая прогрессия) -это дефицитность апоптоза. Описана летальная наследственная болезнь с дефектом гена, кодирующего Fas - одного из специализированных рецепторов для индукции апоптоза, которая проявляется лимфопролиферативным синдромом с системными симптомами, типичными для аутоиммунных заболеваний. Существенная роль в патогенезе многих форм аутоиммунной патологии отводится медленным вирусным и прионо-вым инфекциям, которые, вероятно, могут модифицировать процессы апоптоза и экспрессии важнейших регуляторных молекул.
Одним из центральных аспектов патогенеза является наличие каких-либо молекулярных аномалий. Например, при ревматоидном артрите и ряде других патологий обнаружен дефект гликозилирования Fc-фрагмента собственных антител класса IgG, когда отмечается дефицит сиаловой кислоты и галактозы. Аномальные молекулы IgG образуют между собой конгломераты с сильными иммуногенными свойствами, которые индуцируют аутоиммунный ответ. Наличие молекулярных аномалий генов, ответственных за синтез цитокинов профилей Тх2 и ТхЗ, приводит к тому, что начавшийся аутоиммунный ответ не заканчивается восстановлением аутотолерантности.
Аутоиммунные болезни нередко развиваются в так называемых иммунологически привилегированных органах (мозг, передняя камера глаза, мужские и женские половые железы). К таким заболеваниям относятся рассеянный склероз, симпатическая офтальмия, иммунологическое бесплодие. Когда аутоантигены из этих органов оказываются в несвойственных местах (например, при травме) и имеются какие-либо дополнительные условия усиления их иммуноген-ности (дефицит цитокинов профилей Тх2 и ТхЗ,
И 161
11 Зато № 532
Специфические маркеры аутоиммунных болезней
Таблица 26
| Аутоиммунная патология | Иммунологический маркер |
| Аутоиммунная гемолитическая анемия | Аутоантитела против Rh-антигена |
| Пернициозная анемия | Аутоантитела против внутреннего фактора Касла |
| Вульгарная пузырчатка | Аутоантитела против кадхерина эпидермиса |
| Хроническая идиопатическая крапивница | Аутоантитела против FceRI |
| Тяжелая миастения (myasthenia gravis) | Аутоантитела против ацетилхолиновых рецепторов |
| Аутоиммунный тиреоидит | Аутоантитела против тиреоглобулина |
| Системная красная волчанка | Аутоантитела против ДНК, рибосом |
| Ревматоидный артрит | Т-клетки, специфичные к коллагену II; аутоантитела к Fc-фрагменту собственных IgG с дефектом гликозилирования |
| Инсулинзависимый сахарный диабет (типа 1) | Т-клетки, специфичные к эндоантигену (5-клеток островков Лангерганса |
| Рассеянный склероз | Т-клетки, специфичные к основному белку миелина |
присутствие адъювантов и т.д.), включается аутоиммунный процесс.
Эффекторный этап любого аутоиммунного процесса протекает по одному или чаще нескольким механизмам гиперчувствительности II, III или IV типов (по Gell и Coombs):
II тип: аутоиммунная гемолитическая анемия,
пернициозная анемия, тяжёлая миастения
(myasthenia gravis) и др.;
III тип: системная красная волчанка, системные васкулиты и др.;
IV тип: ревматоидный артрит, рассеянный склероз и др.;
V тип: аутоиммунный тиреоидит и др. эндо-
кринопатии.
Клиническая симптоматика аутоиммунных болезней характеризуется хроническим прогре-диентным течением с деструктивными проявлениями в органах-мишенях. Существует пять патогенетических классов аутоиммунных болезней:
- Класс А, Первичные аутоиммунные болезни с наследственной предрасположенностью. В зависимости от вовлечённости одного или нескольких органов в этом классе выделяют орга-носпецифические болезни (например, аутоиммунный тиреоидит), промежуточные (например, аутоиммунная патология печени и желудочно-кишечного тракта) и органонеспецифические (коллагенозы). Главную роль в патогенезе данных форм играют наследственные молекулярные аномалии.
- Класс В. Вторичные аутоиммунные болезни (например, алкогольный цирроз печени, хроническая лучевая болезнь). Большое значение в патогенезе этих заболеваний имеет длительное воздействие внешних неблагоприятных факторов, которое приводит к модификациям аутоан-тигенов и последующему включению аутоиммунного ответа на них.
- Класс С. Аутоиммунные болезни на основе генетических дефектов комплемента (например, некоторые формы наследственной гемолитической анемии). Эффекторный этап патогенеза данной группы заболеваний чаще всего реализуется по типу П.
- Класс D. Аутоиммунные болезни, связанные с медленными вирусными и прионовыми инфекциями (например, вилюйский энцефалит, болезнь Альцгеймера и др.). Эти болезни имеют самый сложный патогенез, который включает большинство механизмов, упоминавшихся выше. Следует отметить, однако, что некоторые вопросы патогенеза остаются неясными до настоящего времени.
- Класс Е. Комбинированные формы.
Диагностика аутоиммунных заболеваний основана на выявлении специфических аутоанти-тел и аутореактивных Т-лимфоцитов (табл. 26), гистологических и специальных исследованиях.
Лечение аутоимунных болезней связано с попытками восстановления аутотолерантности, назначением противовоспалительных антимеди-аторных препаратов, включая кортикостероиды, а также с генной терапией.
Часть I. ОБЩАЯ НОЗОЛОГИЯ
ОТТОРЖЕНИЕ ТРАНСПЛАНТАТА
Развитие медицины в XX в. привело к создано принципиально новой технологии лечения пересадке органов и тканей. Трансплантации костного мозга, печени, лёгких, сердца ли применяться, особенно в развитых странах мира, очень широко, что позволило продлить утзнь миллионам людей.
Г другой стороны, пересадка чужой ткани
плабиологическим явлением, не известным в
злюции человеческого организма. Ятрогенная
реплантация ни в коем случае не может быть
зеленак беременности - физиологическому про-
ху. когда семиаллогенный плод находится в
:оых условиях с наличием полупроницаемого
rILA-негативного» барьера (плаценты) и в зоне
|<ггвия мощных иммуносупрессорных факто-
юв (ТРФ-Р, ИЛ-4, ИЛ-10, хорионический гона-
лпропини др.).
Однако оказалось, что в целом механизмы
ттторжения трансплантата соответствуют глав-
туу направлениям иммунного ответа на чуже-
лные антигены. Разные клоны наивных Т-лим-
czHTOB реципиента распознают: 1) HLA транс-
лнтата; 2) антигенные пептиды транспланта-
- HLAтрансплантата; 3) антигенные пепти-
i. трансплантата + собственные HLA. В после-
м развиваются все варианты иммунного
■вета,что приводит к формированию цитоток-
гческих Т-лимфоцитов, Т-эффекторов иммун-
о воспаления, специфических иммуноглобу-
жнови соответствующих Т- и В-клеток памя-
Интересно, что существенную роль в иници-
ги иммунного ответа на антигены трансплан-
а имеют Т-лимфоциты, избежавшие положи-
лъной селекции в тимусе и не отличающие
■свои»HLA от «несвоих».
Существуют две формы отторжения транс-
антата в эксперименте (на примере кожного
гкута): первичная и вторичная. Острая пер-
нчная реакция развивается в течение 10-11
дней главным образом за счёт эффекторных Т-клеток и макрофагов. В первые 4-5 дней лоскут выглядит как прижившийся, но к б-7-му дням появляются отёчность, геморрагии, лим-фоцитарно-моноцитарная инфильтрация, а к 10-11-му дням происходит отторжение. Острая вторичная реакция является ускоренной по времени и наступает в период 1-5 дней от момента пересадки, кожный лоскут при этом не успевает даже васкуляризироваться и выглядит как «белый трансплантат». Хроническая реакция отторжения развивается спустя месяцы и годы и опосредуется как иммунными механизмами (лимфоциты, антитела, комплемент, цитокины, адгезивные молекулы), так и неиммунными (нарушения кровообращения в пересаженном органе). Существует также сверхострая реакция отторжения (например, при АВО-несовместимос-ти), которая обусловлена наличием у реципиента гуморальной памяти в отношении антигенов донора; эта форма развивается в течение нескольких минут после трансплантации (или трансфузии крови) и может быть фатальной для пациента.
Проблема эффективности пересадок органов связана прежде всего с эффективной иммуно-супрессивной терапией, т.е. достижением таких подходов в этой области, которые бы имели минимальные побочные эффекты.
Если пересаживаемая ткань содержит им-мунокомпетентные аллогенные клетки, то при наличии у реципиента иммунодефицита может включиться реакция «трансплантат против хозяина». Такое явление наблюдается при пересадке костного мозга и при некоторых иммуно-дефицитах.
Американские учёные J.E. Murray и E.D. Thomas были удостоены Нобелевской премии (1990) за работы в области трансплантологии, которые стали важным подходом к лечению многих болезней человека.
Глава6 / РОЛЬ ИММУННОЙ СИСТЕМЫ В ПАТОЛОГИИ
Дата добавления: 2015-07-14; просмотров: 1422;
