Диаграмма состояния двухкомпонентного хладагента
В случае смесевых хладагентов оба компонента являются летучими низкокипящими жидкостями. При этом возможны два варианта раствора: идеальный раствор – оба компонента испаряются в одинаковой степени и «неидеальный» – если один из компонентов испаряется лучше, то жидкий раствор обогащается более высококипящим компонентом. Рассмотрим оба варианта.
На рисунке 7.4 приведена в общем виде диаграмма идеального раствора.

Рисунок 7.4 Диаграмма состояния идеального раствора двух летучих
жидкостей в координатах давление паров (р)–состав (N)
Для идеальных растворов в соответствие с законом Рауля парциальные давления компонентов А и В и общее давление равны соответственно:
рА = роА∙NА, рВ = роВ∙NВ и р = рА+ рВ = роА∙NА + роВ (1 – NА).
Близкими к идеальными являются растворы оптических изомеров, члены одного гомологического ряда, а иногда и смесь различных по природе соединений. Например, бензол (С6Н6) и 1,1–дихлорэтан (С2Н4Сl2, R150).
На рисунке 7.5 приведены в общем виде возможные варианты диаграмм состояния в случае реального (неидеального) раствора.
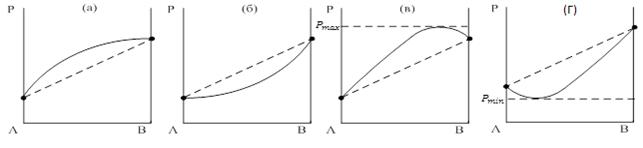
Рисунок 7.5 Диаграммы состояния в координатах давление паров –состав
Из рисунка видно, что возможны положительные (а) и отрицательные (б) отклонения от закона Рауля, а также точки максимума (в) и минимума (г) давлений пара. Положительные отклонения (более высокое давление пара над раствором в сравнении с суммой давлений пара над индивидуальными компонентами) связаны с тем, что при образовании раствора происходит уменьшение межмолекулярного взаимодействия между данными веществами, а в случае отрицательных отклонений происходит усиление межмолекулярного взаимодействия. Точки максимума и минимума соответствуют определенным значениям концентраций раствора.
Появление максимумов и минимумов на диаграммах (б и в) указывает на наличие так называемых азеотропных или нераздельно кипящих смесей. В азеотропных точках состав пара и жидкости совпадает. Азеотропные точки для смесевых хладагентов представляют наибольший интерес, так как для них отсутствует такое явление как «температурный глайд». Следует отметить, что азеотропная точка может изменяться или даже исчезать при изменении внешнего давления, поэтому для практики нужны экспериментальные данные при рабочих давлениях хладагента.
При перегонке летучих жидкостей зависимость состава пара от состава раствора характеризуется двумя законами, открытыми Д. П. Коноваловым.
Первый закон Коновалова – в двойной системе пар по сравнению с жидкостью, находящейся с ним в равновесии, богаче тем веществом, прибавление которого к жидкости повышает давление пара над ней.
Второй закон Коновалова – в точках с максимальной или минимальной
температурой кипения состав жидкости совпадает с составом равновесного с ним пара. Такие точки соответствуют азеотропным или нераздельно кипящим смесям. Например, для смеси этилового спирта и воды азеотропная смесь состоит из 95,57% спирта и 4,43% воды. Такую смесь нельзя разделить обычной перегонкой.
В качестве примера проведем анализ диаграммы состояния системы, изображённой рисунке 7.6. Определим для системы состава а(NА и NВ = 60 и 40%):
1) температуру начала кипения и состав первого пузырька пара,
2) температуру окончания кипения и состав последней капли жидкости,
3) по правилу рычага составы равновесных фаз в точке л.

|
Решение:
Диаграмма состояния данного раствора имеет отрицательное отклонение от идеального раствора и не содержит азеотропной точки. Выше линии 1находится область газа (сухой пар), ниже линии 2 – область жидкости, а между линиями 1 и 2 – область жидкости и пара (влажный пар, двухфазная система). Компонент А имеет более низкую температуру кипения – ТоА, а компонент Вболее высокую температуру кипения – ТоВ.
Если жидкость состава а поместить в цилиндр под поршнем, который будет находиться под постоянным давлением р, и нагревать её, то до точки дбудет жидкая фаза. При температуре Т1 начнется кипение и появиться первый пузырёк пара. Проекция пересечения точки д с линией пара на ось состава даст состав первого пузырька пара (80% А+20% В). Из приведенных значений видно, что пар обогащен более летучим компонентом. При дальнейшем нагревании системы до точки ебудет две фазы (жидкость и газ). Проекция пересечения точки ес линией жидкости на ось состава даст состав последней капли жидкости (40% А+60% В). Как видно из диаграммы температура кипения жидкости повышается от Т1 до Т3. Это связано с тем, что в процессе кипения пар обогащается более низкокипящим компонентом (А), а жидкость – более высококипящим компонентом (В). При этом состав жидкости изменяется по линии жидкости от г до д, а состав пара по линии пара – от e до ж. Если взять пар данного состава а и охлаждать его, то наблюдается обратная картина.
При полной перегонке разделение компонентов не произойдет. Для разделения компонентов необходимо часть фракции, обогащенную требуемым компонентом, отделить и в случае необходимости провести следующую его перегонку. Часто для достижения необходимой степени разделения необходимо провести десятки тысяч таких перегонок, что практически провести сложно. Эта задача решается посредством проведения перегонки на ректификационной колонне. Эффективность ректификационной колонны определяется числом, так называемых теоретических тарелок. Для достижения максимальной эффективности необходимо проведением ректификации в условиях обеспечивающих равновесие в системе жидкость–пар.
При помощи диаграммы состояния можно определить не только составы,
находящихся в равновесии жидкости и пара, но и количественное отношение между ними по правилу рычага. Например, рассмотрим систему в точке л. Проведем через точку л прямую линию (конноду), соединяющую равновесные составы полученных фаз. Точка лявляется точкой опоры рычага и соответствует составу исходной системы, а плечи рычага будут обратно пропорциональны массам полученных фаз. Общая масса всей жидкости и пара будет равна длине рычага к–м. Масса пара так относится к массе жидкости, как плечо рычага к–л к плечу л–м
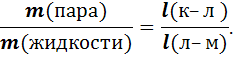
Дата добавления: 2015-08-21; просмотров: 1445;
