Антитела
При встрече животного с новым антигеном, наивные В-лимфоциты становятся способны обеспечивать выработку специфичных к нему антител.
Если одна B-клетка синтезирует за час до 500 молекул иммуноглобулинов, то после ее превращения в плазмоцит синтез возрастает в тысячи раз. Иммуноглобулины поступают в окружающую В-лимфоцит или плазмоцит среду (свободные иммуноглобулины) или остаются на поверхности клетки (связанные с мембраной иммуноглобулины). Свободные иммуноглобулины за пределами выработавшей их клетки связывают растворенные антигены (гуморальный механизм иммунной защиты), а связанные с мембраной – входят в состав специфичного антигенраспознающего рецептора иммунокомпетентной клетки.
Один мономер антител состоит из соединенных дисульфидными мостиками двух одинаковых легких и двух также сходных по составу тяжелых цепей белка. Тяжелые цепи имеют наиболее высокую молекулярную массу, а легкие – низкую. По форме мономер иммуноглобулина напоминают букву Y(рис. 9), у которой сверху симметрично расположены N-концевые (вариабельные) участки всех цепей, а в основании - только С-концевые фрагменты тяжелых цепей (Fc-участок).
N-концевые части легких и тяжелых цепей формируют два одинаковых специфичных антигенсвязывающих центра в одном мономере иммуноглобулина.Такое строение делает каждую молекулу иммуноглобулина двухвалентной. Поэтому она способна одновременно связываться с двумя одинаковыми антигенными детерминантами, а шарнирный участок молекулы (в месте соединения трех плеч иммуноглобулина) позволяет изменять расстояние между ее антигенсвязывающими центрами с учетом удаленности друг от друга повторяющихся антигенов.
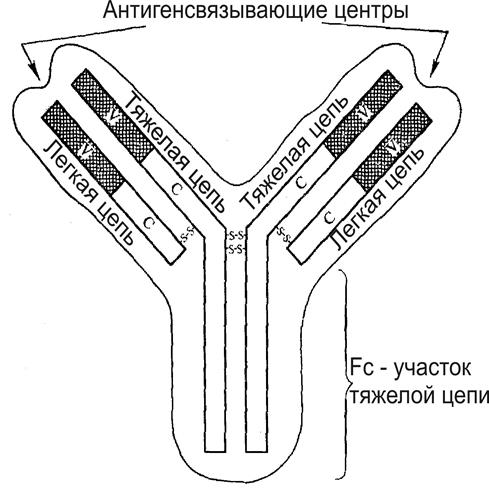
|
| Рис. 9. Двумерное изображение молекулы антитела. Условные обозначения: V - вариабельный (N-концевой) участок цепи, C - константный (С-концевой) участок цепи, -S-S- - дисульфидные связи. |
Образующиеся в организме антитела к одному и тому же антигену могут отличаться друг от друга по строению и свойствам образующегося иммунного комплекса. Поэтому для характеристики иммуноглобулинов определяют их валентность (количество антигенсвязывающих центров), афинность (силу связывания одного центра с антигеном) и авидность (суммарную силу взаимодействий антител с клетками или молекулами).
Эффекторные функции антител определяются строением их Fc-фрагмента. Его состав у одного класса антител относительно постоянен и поэтому данный участок иммуноглобулина назван константным. Например, его строение у молекул IgG позволяет им проникать через плаценту, в то время как IgM в кровь плода не поступают.
Константная область антител также определяет способность разных классов иммуноглобулинов к связыванию компонентов комплемента и взаимодействию с различными собственными (например, макрофагами, тромбоцитами, естественными киллерами, тучными клетками и базофилами) и чужеродными клетками. Это позволяет антителам вызывать опсонизацию, антителозависимую цитотоксичность естественных киллеров, агглютинацию (склеивание) и лизис (растворение) клеток, а также нейтрализацию токсинов, активацию фагоцитов и преципитацию (осаждение) чужеродных частиц.
Кроме того, от строения константной области зависит скорость синтеза и распада антител.
Нейтрализация бактериальных токсинов (и других чужеродных, в том числе и находящихся вне клеток вирусных частиц), опсонизация бактериальных клеток и активация фагоцитов антителами важны потому, что циркулирующие антитела, при связывании с чужеродными структурами, как правило, снижают их патогенность. Образующиеся, при этом иммунные комплексы связываются с компонентом комплемента С3b, что повышает прилипание антигенов к фагоцитам и активирует фагоцитоз. Такие комплексы могут связываться с эритроцитами приматов и тромбоцитами кролика (возникшие при этом агрегаты фагоцитируются гепатоцитами).
Эффективность фагоцитоза низка у тех животных, в крови которых отмечается недостаток С3b или антител. Это свидетельствует о синергизме гуморальных факторов специфической и неспецифической защиты при освобождении макроорганизма от чужеродных структур.
Если вариабельная часть антител обеспечивает их антигенспецифичность, то состав константных областей определяет их неспецифические (эффекторные) свойства и является основанием для деления иммуноглобулинов на пять, различающихся по типу тяжелых цепей классов - IgA, IgG, IgM, IgD и IgE.
Иммуноглобулины класса Асоставляют не более 15% всех антител сыворотки крови, но во внешних секретах и наслизистых оболочках IgA большинство. Данный класс иммуноглобулинов обладает относительно слабой бактерицидностью (в малой степени повышает активность фагоцитов и системы комплемента), но облегчает выведение из организма вирусов и бактерий, препятствуя их связыванию с покровами тела. Исключительная важность IgA заключается в том, что они выполняют свои функции там, где мало других факторов специфической защиты.
Большая часть мономеров IgA синтезируется в строме желез внешней секреции и слизистых оболочек. Затем IgA секретируются в межклеточную среду и проникают в эпителиоциты. Здесь образуются комплексы, состоящие из двух молекул (димера) IgA и секреторного компонента мембран эпителиальных клеток. Сформировавшая при этом секреторная форма IgA (названа секреторным IgA или sIgA) обладает высокой устойчивостью к агрессивным условиям среды на поверхности эпителиального покрова и в слизи.
Именно sIgA является основным видом антител, секретируемых на покровы тела. Его высокие концентрации присутствуют в слюне животных с момента рождения, а также является одним из важнейших защитных компонентов молока и молозива. Это обеспечивает устойчивость новорожденных к бактериальным и даже некоторым вирусным (например, герпетическим) поражениям слизистой оболочки пищеварительного тракта.
Выработка IgA начинается в областях проникновения в организм через слизистые оболочки антигенов. Часть образующихся при этом лимфоцитов через лимфу выходит в кровь и заселяет другие органы и ткани. Поэтому стимуляция антигенами одного участка тела приводит к появлению соответствующих IgA на всех слизистых оболочках и на коже.
Благодаря перечисленным свойствам именно IgA является ведущим фактором специфической защиты организма от проникновения в него через покровы тела чужеродных агентов. Особо следует отметить, что комплексы IgA с антигеном не активируют систему комплемента и поэтому не повреждают собственные слизистые оболочки.
IgD в основном находятся на поверхности лимфоцитов и являются там рецепторами для антигенов. Небольшое количество плазматических клеток, секретирующих IgD, локализуются преимущественно в миндалинах и аденоидной ткани. Наряду с функциями рецептора, IgD могут участвовать в дифференцировке иммуноцитов, а также обладают антивирусными свойствами и активируют систему комплемента по классическому пути.
IgЕ составляют в плазме крови и межклеточных жидкостях не более 0,02% от общего количества антител в организме. Бόльшая часть IgE синтезируется плазматическими клетками слизистых оболочек и лимфоидных фолликулов.
Образование комплекса IgЕ+антиген+IgЕ вызывает секрецию тучными клетками и базофилами содержащихся в их гранулах веществ (гистамин, хемотаксические факторы, компоненты системы комплемента, гепарин), вызывающих хемотаксис макрофагов, эозинофилов и нейтрофилов, активирует фагоцитоз бактерий, ускоряет деструкцию гельминтов и обработанных опсонинами чужеродных частиц.
Нередко комплексы IgE с антигеном вызывают аллергические реакции и провоцируют рефлексы, направленные на выведение антигена из организма (кашель, чихание, рвота).
Основной функцией IgE в здоровом организме, вероятно, является индукция острого воспаления при преодолении антигенами барьера, образованного IgA.
IgG является основным иммуноглобулином крови и межклеточной жидкости. Он имеет наименьшую (по сравнению с другими антителами) молекулярную массу и легко распространяется по внеклеточным секторам организма. Именно IgG способны обеспечивать формирование пассивного иммунитета у плода (переходя через плаценту из крови матери к плоду) и новорожденных (всасываясь в их кровь из молозива, поступившего в пищеварительный тракт при кормлении).
Данный класс иммуноглобулинов непосредственно нейтрализует токсины и вирусы, является опсонином и вызывает хемотаксис нейтрофилов. При связывании с антигеном сразу двух молекул IgG (для этого необходима высокая концентрация антител) активируется классический путь системы комплемента. Именно IgG в присутствии молекул C3b обеспечивают прочное связывание бактерий с макрофагом, и стимулирует фагоцитоз.
Таким образом, IgG является важнейшим специфическим гуморальным фактором вторичного иммунного ответа. Он так же является опсонином и единственным классом антител непосредственно нейтрализующих токсины.
Первыми при иммунном ответе образуются IgM(ранние антитела).В организме новорожденных они синтезируются раньше других классов антител, а у взрослых составляют до 10% от всех иммуноглобулинов плазмы крови.
В жидких средах организма IgM, как правило, являются пентамерами (состоят из пяти мономеров и поэтому являются десятивалентными). Высокая молекулярная масса IgM ограничивает их прохождение через сосудистую стенку (они выходят за пределы сосуда только под влиянием медиаторов воспаления). Поэтому материнские IgM, как правило, не участвуют в иммунных реакциях в организме плода.
Таким образом, преимущественное нахождение в плазме крови, участие в ранних стадиях иммунного ответа, низкая афинность и наибольшая валентность относятся к важнейшим особенностям растворенных IgМ. Последнее свойство компенсирует низкую афинность антигенсвязывающих центров IgМ в тех случаях, когда на чужеродных структурах часто повторяются одинаковые антигенные детерминанты (характерно для оболочек грамотрицательных и жгутиковых бактерий, а также для некоторых вирусов). В этом случае, один пентамер IgM специфически взаимодействует с десятью одинаковыми соседними детерминантами патогена, и общая сила связывания становится высокой. IgM не обеспечивают полной нейтрализации токсинов, но активируют систему комплемента по классическому пути. Благодаря этому (IgM не взаимодействуют с фагоцитов) нагруженные данным классом антител бактерии прилипают к фагоцитам.
Тимуснезависимые антигены всегда вызывают преимущественную выработку только IgM. Такая же реакция наблюдается при первой встрече с тимусзависимым антигеном, а новый или длительный контакт с ним индуцируют выработку нескольких специфичных классов иммуноглобулинов (М, G и А).
Согласно клонально-селекционной теории М.Ф.Бернета, одинаковые антитела являются продуктом одной клетки, а каждый лимфоцит реагирует лишь на один антиген. Причем клетка, образующая антитела, после активации антигеном размножается и возникает клон (множество клеток) от одного предшественника. Поэтому, вызванная антигеном дифференцировка иммуноцитов формирует клоны В-лимфоцитов (из них образуются плазмоциты, синтезирующие антитела той специфичности, на которую запрограммирован их предшественник), секретирующих антитела заданной специфичности и клоны Т-лимфоцитов, осуществляющих клеточные механизмы специфической иммунной защиты.
Любой макроорганизм постоянно контактирует с огромным числом антигенов и реагирует на них выработкой множества антител. Кроме того, даже на одну детерминанту сначала вырабатывается несколько клонов клеток обладающих разным сродством к ней. Поэтому первичный иммунный ответ на один антиген всегда является поликлональным.
Даже в самом совершенном макроорганизме невозможно постоянное поддержание высокой активности всех возникших в ходе жизни эффекторных клонов лимфоцитов. Поэтому часть их после нейтрализации антигена длительно, в неактивном состоянии, хранится в лимфоидных органах, выполняя функцию клеток памяти. Новый контакт с тем же антигеном вызывает быструю пролиферацию клеток продуцирующих в достаточных количествах все наиболее специфичные к нему классы антител (кроме IgD).
Если растворенные иммуноглобулины защищают организм животного, от чужеродных структур непосредственно нейтрализуя антигены, то связанные с цитоплазматическими мембранами антитела входят в состав антигенраспознающих рецепторов иммунокомпетентных клеток.
Основными функциями иммуноглобулинов в составе рецепторов на зрелых лимфоцитах является обнаружение специфических антигенов (или их антигенных детерминант) и передача информации об этом внутрь своей клетки.
Антигенраспознающие рецепторы B-лимфоцитов (BCR) преимущественно содержат мономер IgM и появляются на заключительном этапе дифференцировки B-лимфоцитов в красном костном мозге. Эти рецепторы, после специфического взаимодействия с нативным (растворенным в жидких средах организма) антигеном, ускоряют дифференцировку клонов B-клеток, а также синтез и секрецию ими антител.
Подавляющее большинство антигенраспознающих рецепторов T-лимфоцитов (TCR) относятся к αβ типу, который активируются только после специфического взаимодействия с находящимися на поверхности антигенпредставляющих клеток иммуногенными фрагментами антигена в комплексе с молекулами ГКГС.
На поверхности особой популяции Т-лимфоцитов имеются TCR рецепторы γδ. Их активация не требует присутствия антигенпрезентирующих клеток и происходит при взаимодействии с нативными антигенами.
Таким образом, антигенраспознающие рецепторы обеспечивают обнаружение лимфоцитами специфичных антигенов и запускают иммунный ответ на них.
Даже в плазме крови и на незрелых В-лимфоцитах здоровых новорождённых присутствуют генетически запрограммированные естественные (природные или нормальные) антитела к определенному перечню антигенов. Это является одной из причин нечувствительности животных одного вида к возбудителям заболеваний других видов животных. Некоторая часть нормальных антител может также появляться в результате «неприметной» иммунизации компонентами корма.
Дата добавления: 2015-07-14; просмотров: 1950;
