Спин электрона.
При изучении спектра атома водорода обнаружили, что они имеют дуплетную структуру (каждая спектральная линия расщеплена на две полоски). Чтобы объяснить это явление предположили, что электрон обладает собственным механическим моментом импульса – спином (  ). Первоначально спин связывали с вращением электрона вокруг своей оси. Впоследствии выяснилось, что это ошибочно. Спин – это внутреннее квантовое свойство электрона – у него нет классического аналога. Спин квантуется по закону:
). Первоначально спин связывали с вращением электрона вокруг своей оси. Впоследствии выяснилось, что это ошибочно. Спин – это внутреннее квантовое свойство электрона – у него нет классического аналога. Спин квантуется по закону:
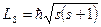 , ,
|
где 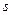 - спиновое квантовое число.
- спиновое квантовое число.
По аналогии с орбитальным моментом импульса, проекция 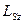 спина квантуется так, что вектор
спина квантуется так, что вектор  может принимать
может принимать 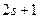 ориентаций. Так как спектральная линия расщепляется только на две части, то ориентаций
ориентаций. Так как спектральная линия расщепляется только на две части, то ориентаций  только две:
только две: 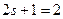 , отсюда
, отсюда 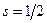 . Проекция спина на выделенное направление определяется выражением:
. Проекция спина на выделенное направление определяется выражением:
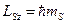 , ,
|
где 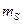 - магнитное квантовое число. Оно может иметь только два значения
- магнитное квантовое число. Оно может иметь только два значения 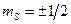 .
.
Таким образом, опытные данные привели к необходимости введения спина. Поэтому для полного описания состояния электрона в атоме необходимо наряду с главным, орбитальным и магнитным квантовыми числами задавать еще магнитное спиновое квантовое число.
Принцип Паули. Распределение электронов в атоме по состояниям.
Состояние каждого электрона в атоме характеризуется четырьмя квантовыми числами:
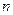 (
( 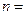 1, 2, 3,…) – квантует энергию
1, 2, 3,…) – квантует энергию 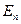 ,
,
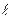 (
( 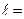 0, 1, 2,…,
0, 1, 2,…, 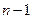 ) – квантует орбитальный механический момент
) – квантует орбитальный механический момент 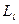 ,
,
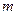 (
( 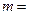 0,
0, 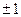 ,
, 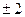 ,…,
,…, 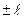 ) – квантует проекцию момента импульса на заданное направление
) – квантует проекцию момента импульса на заданное направление 
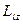 ,
,
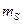 (
( 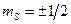 ) – квантует проекцию спина на заданное направление
) – квантует проекцию спина на заданное направление 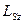 .
.
С возрастанием 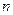 растет энергия. В нормальном состоянии атома электроны находятся на самых низких энергетических уровнях. Казалось бы, что все они должны быть в состоянии 1s. Но опыт показывает, что это не так.
растет энергия. В нормальном состоянии атома электроны находятся на самых низких энергетических уровнях. Казалось бы, что все они должны быть в состоянии 1s. Но опыт показывает, что это не так.
Швейцарский физик В.Паули сформулировал принцип: в одном и том же атоме не может быть двух электронов с одинаковыми квантовыми числами 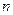 ,
, 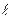 ,
, 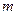 ,
, 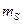 . То есть два электрона должны отличаться по крайней мере значениями одного квантового числа.
. То есть два электрона должны отличаться по крайней мере значениями одного квантового числа.
Значению 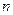 соответствует
соответствует 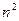 состояний, отличающихся значениями
состояний, отличающихся значениями 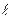 и
и 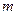 . Но еще
. Но еще 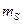 имеет два значения
имеет два значения  и
и 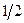 , значит всего
, значит всего 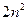 состояний. Поэтому в состояниях с заданным
состояний. Поэтому в состояниях с заданным 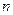 могут находиться
могут находиться 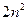 электронов. Совокупность электронов с одинаковым
электронов. Совокупность электронов с одинаковым 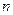 называется слоем, а с одинаковыми
называется слоем, а с одинаковыми 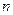 и
и 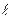 - оболочкой.
- оболочкой.
Поскольку орбитальное квантовое число 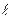 принимает значения от
принимает значения от 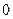 до
до 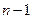 , число оболочек в слое равно
, число оболочек в слое равно 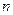 . Количество электронов в оболочке определяется магнитным и спиновым квантовыми числами: максимальное число электронов в оболочке с заданным
. Количество электронов в оболочке определяется магнитным и спиновым квантовыми числами: максимальное число электронов в оболочке с заданным 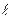 равно
равно  . Обозначение слоев и распределение электронов по слоям и оболочкам представлены в таблице 1.
. Обозначение слоев и распределение электронов по слоям и оболочкам представлены в таблице 1.
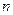
| Символ слоя | Максимальное число электронов в оболочках

| Макс. число электронов в слое 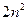
| ||||
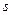 
| 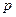 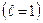
| 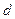 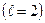
| 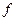 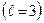
| 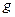 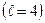
| |||
| K | |||||||
| L | |||||||
| M | |||||||
| N | |||||||
| O |
Пользуясь распределением электронов по состояниям можно объяснить периодический закон Менделеева. Каждый последующий атом имеет на один электрон больше, располагается он в состоянии с возможно меньшей энергией.
Периодическая система элементов начинается с простейшего атома водорода. Его единственный электрон находится в состоянии 1s, характеризуемом квантовыми числами 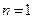 ,
,  и
и 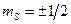 (ориентация спина произвольна).
(ориентация спина произвольна).
В атоме 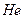 два электрона находятся в 1s состоянии с антипараллельными спинами. На атоме
два электрона находятся в 1s состоянии с антипараллельными спинами. На атоме 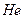 заканчивается заполнение K-слоя, что соответствует завершению 1 периода Периодической системы Менделеева.
заканчивается заполнение K-слоя, что соответствует завершению 1 периода Периодической системы Менделеева.
У атома 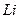 3 электрона. Согласно принципу Паули третий электрон уже не может разместиться в целиком заполненном слое К и занимает наинизшее энергетическое состояние с
3 электрона. Согласно принципу Паули третий электрон уже не может разместиться в целиком заполненном слое К и занимает наинизшее энергетическое состояние с 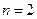 (L-слой), то есть 2s состояние. Электронная конфигурация для атома
(L-слой), то есть 2s состояние. Электронная конфигурация для атома 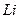 : 1
: 1  2
2 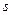 . Атомом
. Атомом 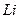 начинается 2 период Периодической системы Менделеева. Заканчивается 2 период инертным газом неоном. У атома неона полностью заполнена 2p оболочка и полностью заполнен слой L.
начинается 2 период Периодической системы Менделеева. Заканчивается 2 период инертным газом неоном. У атома неона полностью заполнена 2p оболочка и полностью заполнен слой L.
Одиннадцатый электрон 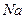 размещается в M слое (
размещается в M слое ( 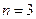 ), занимая наименьшее состояние 3s. Электронная конфигурация для
), занимая наименьшее состояние 3s. Электронная конфигурация для 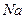 : 1
: 1  2
2  2
2 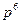 3
3 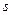 . Электрон 3s (как и 2s у лития) является валентным, поэтому свойства
. Электрон 3s (как и 2s у лития) является валентным, поэтому свойства 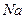 подобны свойствам
подобны свойствам 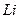 .
. 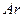 завершает 3 период. Его электронная конфигурация
завершает 3 период. Его электронная конфигурация 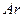 : 1
: 1  2
2  2
2 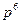 3
3  3
3 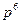 . Начиная с атома калия в застройке электронных оболочек происходит отклонение. Вместо заполнения 3d оболочки, заполняется сначала 4s (
. Начиная с атома калия в застройке электронных оболочек происходит отклонение. Вместо заполнения 3d оболочки, заполняется сначала 4s ( 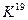 : 1
: 1  2
2  2
2 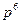 3
3  3
3 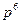 4
4 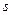 ). Это происходит потому, что оболочка 4s энергетически выгоднее, ближе расположена к ядру, чем 3d. После заполнения 4s заполняется 3d, а затем 4р оболочка, которая дальше от ядра, чем 3d.
). Это происходит потому, что оболочка 4s энергетически выгоднее, ближе расположена к ядру, чем 3d. После заполнения 4s заполняется 3d, а затем 4р оболочка, которая дальше от ядра, чем 3d.
С такими отклонениями приходится сталкиваться и дальше. Оболочка 4f, которая содержит 14 электронов, начинает заполняться после того, как заполняются 5s, 5p, 6s. В итоге у элементов 58-71 добавляющиеся электроны садятся в 4f состояния, а внешние электронные оболочки у этих элементов одинаковы. Поэтому их свойства близки. Эти элементы называют лантанидами. Аналогично близки по свойствам актиниды (90-103), где заполняется 5f оболочка при неизменном 7  .
.
Таким образом, открытая Менделеевым периодичность в химических свойствах элементов объясняется повторяемостью в структуре внешних оболочек у атомов родственных элементов.
Валентность химического элемента равна числу электронов в s или р оболочке с максимальным n. Если s, p, d,… оболочки полностью заполнены, то их спины скомпенсированы. Такие элементы являются диамагнетиками. Если оболочки не полностью заполнены, то имеются не скомпенсированные спины. Это парамагнетики.
Лекция 13
Оптические квантовые генераторы
Одним из крупнейших открытий последних десятилетий являются лазеры (ОКГ). Их работа основана на явлении усиления электромагнитных колебаний при помощи индуцированного (вынужденного) излучения. Возможность такого излучения была теоретически предсказана в 1916 году А.Эйнштейном. В 1939 году советский физик Фабрикант, изучая газовые разряды, указал на возможность усиления света при помощи индуцированного излучения. В 1952 году советские физики Басов и Прохоров, американский физик Таунс независимо друг от друга создали первый мазер. В мазере происходит усиление электромагнитных колебаний в сантиметровом диапазоне длин волн. За это открытие они были удостоены Нобелевской премии. В 1960 году американский физик Нейман построил первый лазер. В лазере происходит усиление волн оптического диапазона индуцированным излучением. Лазеры дают излучение с уникальными свойствами и применяются в разных областях науки и техники. Практическое применение лазеров это медицина, химия, вычислительная техника, военное дело.
На примере лазеров проявляется связь теории и практики. Предсказаны лазеры были теоретически. В настоящее время практика опережает теорию, ставит перед ней вопросы, которые еще следует решить, например, вопрос о степени монохроматичности излучения, о максимально возможном КПД лазера.
Дата добавления: 2015-08-21; просмотров: 1021;
