Многоэлектронные атомы. Спин электрона. Распределение электронов по энергетическим уровням.
Спин электрона.
В атоме водорода (или водородоподобном) энергия атома определяется только главным квантовым числом п и не зависит от двух других квантовых чисел. Это связано с тем, что электрическое поле ядра атома – кулоновское, т.е. обратно пропорционально квадрату расстояния. В многоэлектронных атомах ситуация меняется. Например, в атомах щелочных металлов внешний (валентный) электрон находится в электрическом поле атомного остова, включающего в себя ядро и внутренние электроны. Это поле уже не будет обратно пропорционально квадрату расстояния до центра. Благодаря этому получается зависимость энергии электрона не только от главного квантового числа п, но и от орбитального числа l. С этим связано отличие энергетического спектра, а, следовательно, и спектра испускания щелочных металлов от водородного.
Исследование спектров щелочных металлов при помощи приборов с большой разрешающей способностью показало еще одно их отличие от спектра водорода. Оказалось, что спектральные линии щелочных металлов имеют так называемую дублетную структуру, т.е. каждая линия состоит из двух очень близко расположенных. Примером может служить желтый дублет натрия, состоящий из двух линий с длинами волн 589,0нм и 589,6нм. То же относится и к другим линиям. Для описания этой структуры трех квантовых чисел оказалось недостаточно – потребовалось четвертое квантовое число.
Это явилось главным мотивом, послужившим американским ученым Дж. Уленбеку и С. Гаудсмиту в 1925 г. для введения гипотезы о спине электрона. Суть ее состоит в том, что у электрона есть не только момент импульса, связанный с перемещением его как целого вокруг ядра. Электрон имеет также собственный или внутренний механический момент, названный спином (от английского слова tо spin – вертеться). Первоначально Уленбек и Гаудсмит предполагали, что спин обусловлен вращением электрона вокруг своей оси, напоминая в этом смысле классический волчок. Существовавшая в то время модель атома получила еще большее сходство с Солнечной системой. Однако от такого модельного представления пришлось по ряду причин отказаться. В 1928 г. П. Дирак показал, что спин электрона содержится в его теории Электрона, основанной на релятивистском волновом уравнении. Таким образом, спин электрона оказался квантово – релятивистским эффектом, не имеющим классического истолкования. Затем концепция спина была распространена на другие элементарные частицы.
Величина собственного момента импульса М  и его проекции на выделенное направление
и его проекции на выделенное направление 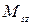 определяются спиновым квантовым числом s и магнитным спиновым квантовым числoм
определяются спиновым квантовым числом s и магнитным спиновым квантовым числoм 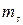 :
:
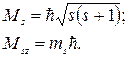 (3.15.1)
(3.15.1)
Для электрона s = 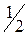 ,
, 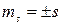
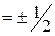 .
.
Рассмотрим на примере атома натрия, как наличие спина объясняет дублетную структуру линий. Можно показать, что момент атомного остатка, включающего в себя ядро и внутренние электроны, равен нулю. Поэтому момент атома натрия равен моменту валентного электрона, а он, в свою очередь, складывается из орбитального и спинового моментов. Сложение этих моментов осуществляется по квантовым законам. Полный механический момент определяется квантовым числом j:
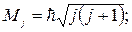
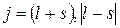 (3.15.2)
(3.15.2)
Таким образом, энергия данного состояния зависит от главного квантового числа п и от квантового числа и различается для случая «параллельной» и «антипараллельной» ориентации орбитального и спинового моментов, что приводит к небольшому различию в энергиях излученных фотонов.
Принцип Паули. Распределение электронов в атоме по энергетическим уровням.
В отличие от макроскопических тел однотипные частицы микромира (электроны и др.) обладают совершенно одинаковыми свойствами: у них одинаковы масса, электрический заряд, спин и др. В связи с этим возникает вопрос, как отличить одну частицу от другой. Рассмотрим систему из двух электронов. С классической точки зрения электрон движется по определенной траектории, так что принципиально возможно проследить за движением каждого. Обнаружив электрон в какой – то последующий момент времени, можно в принципе сказать, будет это электрон 1 или электрон 2. С изложенной точки зрения одинаковые частицы принципиально различимы или индивидуализированы.
Иначе обстоит дело с точки зрения квантовой механики, отвергающей классическое представление о движении частицы по траектории. Состояние системы частиц описывается в квантовой механике волновой функцией, которой дается вероятностное толкование. Обнаружив в какой – то момент времени один из электронов, принципиально невозможно решить, будет это электрон 1 или 2. Одинаковые частицы принципиально неразличимы или обезличены. Это положение можно сформулировать в виде принципа тождественности одинаковых частиц: в системе одинаковых частиц реализуются только такие состояния, которые не меняются при перестановке местами двух любых частиц.
Отсюда следует положение, высказанное в 1925 г. швейцарским физиком В. Паули, которое носит название принципа Паули: в квантовомеханической системе не могут находиться две тождественные частицы с полуцелым спином. Этот принцип дает объяснение периодической повторяемости свойств атомов.
Состояние электрона определяется четырьмя квантовыми числами: главным п, орбитальным l, магнитным 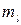 , магнитным спиновым
, магнитным спиновым 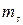 . Из принципа Паули следует, что в атоме не может быть двух электронов, имеющих одинаковыми все четыре квантовых числа. Учитывая возможные значения квантовых чисел, можно найти, что при заданном значении главного квантового числа п количество электронов, у которых отличаются остальные квантовые числа равно 2
. Из принципа Паули следует, что в атоме не может быть двух электронов, имеющих одинаковыми все четыре квантовых числа. Учитывая возможные значения квантовых чисел, можно найти, что при заданном значении главного квантового числа п количество электронов, у которых отличаются остальные квантовые числа равно 2 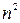 .
.
Периодическая система элементов Менделеева.
Высказанное положение объясняет построение периодической системы химических элементов Д.И.Менделеева. В основе систематики химических элементов лежит заряд ядра. Если за единицу принять элементарный заряд е, то заряд ядра будет выражаться целым числом, которое принято обозначать Z. Это число определяет номер химического элемента в периодической системе и число электронов в атоме. Свойства же элемента зависят прежде всего от числа электронов в электронной оболочке и от ее строения. Химические свойства элемента определяются наружными электронами электронной оболочки.
Совокупность электронов атома с заданным значением главного квантового числа образуют электронный слой. Слои принято обозначать прописными буквами латинского алфавита K, L, M, N,… Совокупность электронов с заданными значениями п и l образует оболочку. Оболочкой называется группа состояний, близких друг к другу по энергии. Электроны из одной оболочки отличаются друг от друга по энергии гораздо меньше, чем электроны из различных оболочек.
Рассмотрим теперь, как меняются электронные конфигурации при переходе от одного атома к другому в порядке возрастания их атомных номеров Z. При возрастании Z на единицу увеличивается заряд ядра, а к электронной оболочке атома добавляется один электрон. При этом вновь получаемая конфигурация из Z+1 электронов должна обладать наименьшей энергией. Однако, в состоянии с наименьшей энергией, соответствующей состоянию с п = 1, могут находиться только два электрона, у которых не совпадают все квантовые числа, т.е. не являющихся тождественными. Поэтому только у водорода и гелия в основном состоянии электроны находятся на К – слое (п=1). Когда же в атоме появляется третий электрон (литий), он не может находиться в состоянии с п=1 и начинается заполнение L – слоя (п=2), который может содержать уже 8 электронов. Заполнение L- слоя заканчивается на неоне. И так далее. Таким образом идет заполнение электронных оболочек, начиная с низшей.
Квантовая теория объясняет происхождение периодического закона Д.И.Менделеева. В химическую связь вступают только те электроны, которые при сближении атомов могут изменить свое состояние. Такие электроны называют валентными, и они находятся на внешних оболочках атомов. Атомы с одинаковым числом валентных электронов ведут себя сходным образом, проявляя близкие химические, оптические, электрические и магнитные свойства.
Размеры всех атомов имеют один и тот же порядок величины ~ 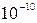 м, возрастание порядкового номера почти не сказывается на размере атома. Это объясняется тем, что, с одной стороны, с ростом заряда ядра усиливается притяжение к нему электронов, что должно вести к уменьшению размеров атома. С другой же стороны, из – за принципа Паули увеличение числа электронов приводит к заполнению состояний с большим удалением электронов от ядра, что ведет к увеличению размеров атома. Компенсация этих двух факторов как раз и приводит к тому, что размеры атомов остаются одного порядка.
м, возрастание порядкового номера почти не сказывается на размере атома. Это объясняется тем, что, с одной стороны, с ростом заряда ядра усиливается притяжение к нему электронов, что должно вести к уменьшению размеров атома. С другой же стороны, из – за принципа Паули увеличение числа электронов приводит к заполнению состояний с большим удалением электронов от ядра, что ведет к увеличению размеров атома. Компенсация этих двух факторов как раз и приводит к тому, что размеры атомов остаются одного порядка.
Характеристическое рентгеновское излучение.
При переходе с одного энергетического уровня на другой атомы излучают (или поглощают) электромагнитную энергию. Если это переходы внешних электронов, то излучение имеет частоты в оптическом диапазоне. Но атомы излучают не только при переходах внешних электронов. Атом можно возбудить и путем удаления одного из электронов внутренней заполненной оболочки, например, бомбардируя атом пучком электронов с достаточной энергией. После такого возбуждения атом будет излучать при электронных переходах с более высоких оболочек в освободившееся состояние. Такое излучение находится в рентгеновском диапазоне, т.е. имеет гораздо бóльшую частоту. Такое излучение называется характеристическим, поскольку зависит от вида энергетического спектра атома, т.е. зависит от вещества.
Дата добавления: 2015-08-08; просмотров: 1422;
