Ферменты.
Фермент – в переводе с латинского fermentum – брожение. Синонимом ферментов являются энзимы. Наука о ферментах – энзимология. С химической точки зрения ферменты– это специфические белки, они могут быть либо простые белки, при гидролизе которых образуются только альфа-аминокислоты, и могут быть сложные белки, которые кроме могут содержать небелковые компоненты, которые называются ко-ферменты.
Ко-фермент, который сам по себе не обладает ферментативной активностью, а активен только в составе биокомплекса колафермента.
Ферменты – это биологические катализаторы.
Ко-фермент касается органического вещества небелковой природы (чаще всего ко-фермент – это витамин).
Ко-фактор – это неорганические ионы (могут быть ионы Mg, Zn, K), которые необходимы для наибольшей активности фермента.
Белковая часть в колаферменте – это термомобильная, высокомолекулярная часть. Активность фермента и его специфичность зависит от уникальной третичной структуры апо-фермента. Сама каталитическая функция связана с ко-ферментом.
Если же фермент – простой белок, то и специфичность и каталитическая функция связаны с уникальной третичной структурой белковой молекулы.
В настоящее время описано более 2000 различных ферментов, а синтезирован только один – рибонуклеаза.
Свойства ферментов:
1. Специфичность ферментов. По специфичности все ферменты можно разделить на 4 группы:
· Ферменты обладающие абсолютной специфичностью, т.е. фермент, действующий на один субстрат (например, фермент уреаза, с помощью которого идет реакция расщепления мочевины водой. Под действием фермента аргиназа расщепление)
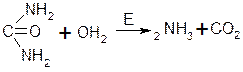
Аргиназа:
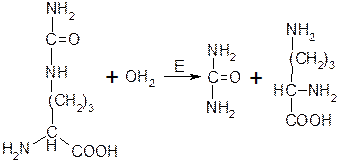
· Ферменты, обладающие абсолютно-групповой специфичностью. Ферменты этой группы действуют на один тип химической связи, но в полнее определенном месте. Например, ферменты пептидазы – расщепляют пептидные связи в белках. Фермент хемотрепсин – расщепляет все белки, но по связи, где C=O группа принадлежит ароматической аминокислоте, а также на стыке ароматической и дикарбоновой аминокислоты.
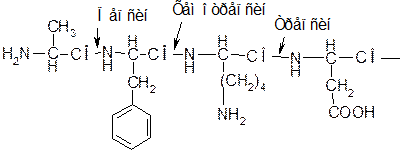
· Относительно-групповая специфичность. Пример: липаза – расщепляет все сложно-эфирные связи между спиртом и органической карбоновой кислотой.
· Стереоспецифичность. Все ферменты стереспецифичны. Все природные белки состоят из маинокислот L-ряда, поэтому ферменты будут расщеплять белки, которые состоят из L-аминокислот. Под действием фермента фумараза происходит отщепление (образуется фумаровая кислота) или присоединение (образуется яблочная кислота) молекулы воды.
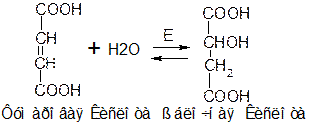
2. Температурный фактор. Скорость любой химической реакции возрастает с повышением температуры. Для большинства ферментативных реакций повышение температуры в пределах до 40 градусов. С повышением температуры больше, чем 40 градусов происходит торможение в силу изменения структуры ферментов.
3. Влияние Ph. С изменением Ph среды свойства кислот могут изменяться. Изменение Ph среды от оптимального может привести к тому, что третичная структура не будет реализована.Это приведет к тому, что белок потеряет свою ферментативную активность. У разных ферментов имеется свой оптимум Ph. Например, пепсин работает в желудке, поэтому для него оптимальным является кислая среда. Для трепсина и хемотрипсина оптимальной является слабощелочная среда, т.к. они работают в кишечнике. Аргиназа – очень щелочная среда. Амилаза – в слюне, т.е. оптимальной является нейтральная среда.
4. Зависимость скорости ферментативной реакции от концентрации субстрата. Если ферментативная реакция протекает при тщательно контролируемых условиях. То изменение скорости по мере изменения концентрации субстрата в большинстве случаев описывается уравнением Михаэлиса-Ментена.
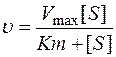
[S] – концентрация субстрата
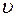 - скорость с изменением концентрации субстрата
- скорость с изменением концентрации субстрата
Vmax - максимально возможная скорость для данного фермента в данных условиях.
 Кm – константа Михаэлеса, это характеристика данного фермента
Кm – константа Михаэлеса, это характеристика данного фермента
Дата добавления: 2015-08-20; просмотров: 1374;
