Турбидиметрия
ПНД Ф 14.1:2:3:4.264-2011 Методика измерений массовой концентрации бария в питьевых, поверхностных, подземных пресных и сточных водах турбидиметрическим методом с хроматом калия.
ПНД Ф 14.1:2.159-2000 (2005 г.) Методика выполнения измерений массовой концентрации сульфат-иона в пробах природных и сточных вод турбидиметрическим методом.
РД 52.24.405-2005 Массовая концентрация сульфатов в водах. Методика выполнения измерений турбидиметрическим методом
ПНД Ф 13.1.46-04 Методика выполнения измерений массовой концентрации серной кислоты, паров и аэрозолей триоксида серы (в пересчете на серную кислоту) в пробах промышленных выбросов турбидиметрическим методом.
ПНДФ 13.1.42-2003 (2012 г.) Методика выполнения измерений массовой концентрации хлористого водорода в пробах промышленных выбросов в атмосферу турбидиметрическим методом.
ПНД Ф16.1:2:2.2:3.37-2002 (2011 г.) Методика измерений валового содержания серы в почвах, грунтах, донных отложениях и отходах турбидиметрическим методом.
Нефелометрия
ПНД Ф 14.1:2.247-07 Методика выполнения измерений массовых концентраций неионогенных синтетических поверхностно-активных веществ (СПАВ) в пробах природных и сточных вод нефелометрическим методом.
3.3.3 МОЛЕКУЛЯРНАЯ СПЕКТРОФЛУОРИМЕТРИЯ
Эффект
Люминесценция- это свечение химических соединений без нагревания или холодное свечение. Известно несколько видов люминесценции, например:
- фотолюминесценция – свечение химических соединений после поглощения электромагнитного излучения оптического диапазона. Фотолюминесценцию подразделяют на флуоресценцию (свечение после 10-8-9 с после УФ-облучения) и фосфоресценцию (свечение после 10-2 … 10-3 с после УФ-облучения);
- катодолюминесценция – свечение химических соединений после его бомбардировки пучком быстролетящих электронов;
- хемилюминесценция – свечение химических соединений – продукта химической реакции без внешнего воздействия;
- рентгенолюминесценция – свечение химических соединений после облучения его рентгеновским излучением;
и др.
Все люминесцирующие химические соединения имеют общее название – люминофоры. Они могут находиться в любом агрегатном состоянии. В количественном химическом анализе в основном используется флуоресценция, часть объектов анализируют методом рентгенофлуоресценции и хемилюминесценции.
При комнатной температуре заселен уровень S0,n0. В фотолюминесценции переход частиц в возбужденное состояние происходит при облучении химических соединений анализируемого вещества ультрафиолетовым светом большой интенсивности от внешнего источника УФ-света.
Между актом поглощения и актом испускания молекула некоторое короткое время (например, 10-8 с) находится в возбуждённом электронном состоянии. За это время в молекуле успевает произойти большое количество самых разнообразных процессов: перераспределение колебательной энергии внутри молекулы, частичное преобразование электронной энергии в колебательную энергию ядер, передача части энергии окружающей среде, а иногда и полная передача энергии возбуждения другим таким же молекулам. В ряде случаев за это время осуществляется сложный фотохимический процесс изменения структуры или распада молекулы.
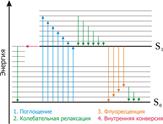
Для того чтобы молекула или атом излучали энергию, нужно чтобы электроны очень быстро перешли с возбужденных колебательных уровней (v*1,v*2,…v*i,) первого возбужденного электронного состояния S1*на основной колебательный уровень v*0 этого же электронного состояния, т.е. чтобы все электроны оказались на основном колебательном уровне первого возбужденного состояния, рис. 9.4.1. Это может произойти за счет столкновения с окружающими молекулами, тогда избыточная колебательная энергия очень быстро теряется до значений энергий основного колебательного состояния первого возбужденного электронного состояния (внутренняя конверсия). В конденсированных фазах вероятность таких переходов велика. Переход в основное невозбуждённое состояние (S0,v0) в этом случае сопровождается излучением – флуоресценцией. Электроны могут перейти с основного колебательного уровня первого возбужденного состояния (S1*,v*0),если оно устойчиво, что редко бывает, в T1*-состояние (T1*,v*0). Это явление называется интеркомбинационной конверсией. Тогда экспериментально можно наблюдать явление фосфоресценции. Природа этих явлений была изучена в 20-х годах прошлого столетия Вавиловым
С. И.
 |
 S1*
S1*



 v1*
v1*

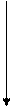

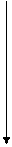
 v0* T1*
v0* T1*

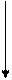

 v0
v0
 | |
 | |
 |
 S0
S0
 v0
v0
Поглощение Флюоресценция Фосфоресценция (Правило Гунда: ЕТ1 <ЕS1)
Рис. 9.4.1 Схема переходов электронов в молекуле при облучении её УФ-излучением
Различные переходы будут зарегистрированы прибором в виде спектра излучения молекул – спектра люминесценции. Спектр люминесценции состоит из полос излучения. Каким бы УФ- светом внешнего источника молекулы химических соединений не облучали, люминесценция от этого не зависит, то есть спектр люминесценции не зависит от длины волны облучения, приводящего к возбуждению молекул химических соединений, но всегда длина волны облучения (λобл.) будет меньше, чем длина волны люминесценции (λлюм.). Это правило Стокса – Ломмеля, рис. 9.4.2.
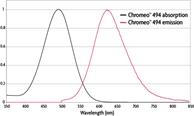
Рис.9.4.2 Правило Стокса – Ломмеля для спектров поглощения и люминесценции соединения
Данное правило принято объяснять потерей некоторой части поглощённой энергии на тепловое движение молекул. Однако существуютт антистоксовские люминофоры, излучающие более коротковолновое излучение, чем падающее. Как правило, одно и то же вещество способно испускать излучение как в стоксовой, так и в антистоксовой областях спектра относительно частоты возбуждающего люминесценцию излучения.
Полосы излучения в спектре люминесценции при комнатной температуре бесструктурные и очень широкие, ∆λ = 100…120 нм, рис. 9.4.3.
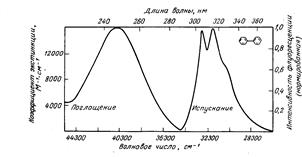
Рис.9.4.3 Типичная форма полос поглощения и люминесценции в спектрах
При понижении температуры пробы анализируемого вещества, например, раствора, до температуры жидкого азота (77 оК) спектры флуоресценции становятся структурированными или линейчатыми, состоящими из набора узких полос, рис. 9.4.4. Эти спектры называют спектрами Шпольского, в честь открывателя этого эффекта. Их используют для качественного анализа, иногда и для количественного, например, для определения ароматическизх и полиароматических соединений в объектах окружающей среды.

Рис. 9.4.4. Спектры флуоресценции (слева) и возбуждения флуоресценции (справа)
соединения (CH3)2N(CH)4CO(CH)4N(CH3)2 в н-октане при 4,2 К.
Для многих люминофоров наблюдается зеркальное подобие спектров поглощения и излучения (правило Лёвшина). Форма кривых определяется распределением колебательных уровней {n} и {n*} S0 и S1- состояний. Оно часто одинаково, поэтому спектры получаются симметричными. Это явление используется для изучения строения молекул, рис. 9.4.5.
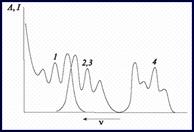
Рис. 9.4.5. Относительное расположение спектров поглощения (1), флуоресценции (2),
замедленной флуоресценции (3), фосфоресценции (4):1: A = f (ν); 2, 3, 4: I = f (ν)
Чем больше раздвинуты спектры поглощенной и излученной энергии, тем более надежно определение компонента в пробе анализируемого вещества флуоресцентным методом.
Характеристиками метода флуориметрии являются величины энергетического Вэ и квантового Вкв выходов флуоресценции:
1.Вэ – энергетический выход флуоресценции Вэ = Ел /Епогл
где Ел – энергия, излучаемая молекулами химического соединения;
Епогл – поглощенная энергия возбуждения.
2. Вкв– квантовый выход флуоресценции Вкв = Nл/Nпогл
где Nл – число излученных и Nпогл – число поглощенных квантов света.
Вэ = Ел /Епогл = Nлhnл/Nпоглhnпогл = Nлnл/Nпоглnпогл = Вкв nл/nпогл
Вэи Вкв характеризуют эффективность преобразования энергии поглощения в энергию излучения. Чем больше Вэи Вкв, тем интенсивнее флуоресценция от одного и того же количества молекул, тем меньшее количество компонента может быть определено этим методом в пробе анализируемого вещества.
Энергетический выход Вэнаходят экспериментально, облучая пробу анализируемого вещества светом с разными длинами волн поочередно, начиная с ультрафиолетового света и кончая видимым.
На рис. рис. 9.4.6 представлена зависимость энергетического выхода флуоресценции раствора флуоресцеина с добавкой NН4ОН в воде от длины волны возбуждающего света, полученная в 1927 г. С.И.Вавиловым. По оси ординат отложен энергетический выход люминесценции водного раствора аммиачной соли флуоресцеина. начале, от 254 до 410 мкм, идет линейное нарастание выхода. Затем, в интервале от 410 до 510 мкм, он остаётся почти постоянным и, наконец, быстро падает.
В области линейного возрастания энергетического выхода квантовый выход флуоресценции Bкв не зависит от частоты возбуждающего света. Это правило справедливо для многих люминофоров как в жидком, так и в твёрдом состоянии с различной степенью сложности и с различным механизмом свечения, оно получило название закона Вавилова.
1 П Ш
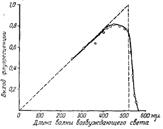
Рис. 9.4.6 Зависимость энергетического выхода флуоресценции раствора флуоресцеина + NН4ОН
в воде от длины волны возбуждающего света
http://www.heuristic.su/effects/catalog/est/byId/description/1021/index.html
Область Ш называется областью тушения люминесценции. Явление тушения люминесценции наблюдается в растворах с концентрацией частиц более 10-4 моль/дм3 из-за увеличения вероятности безизлучательных переходов при столкновении с другими молекулами, например, кислородом.
Некоторые молекулы химических соединений при пониженных температурах сильно люминесцируют. Повышение температуры меняет энергетическое состояние молекул и безизлучательные переходы становятся более вероятными. Химическое взаимодействие особенно с О2, NO, J2 ,Ag+, Cu2+, Fe3+ тушит флуоресценцию люминофоров.
При комнатной температуре флуоресценцией обладают молекулы, содержащие РЗЭ, алифатические, насыщенные циклические, ароматические, с большой сопряженной системой двойных связей (π-связей) органические соединения и комплексные соединения органических соединений с ионами металлов. Наиболее известными являются хинин, флуоресцеин, эозин, акридиновые красители (акридиновый оранжевый, акридиновый желтый), родамины (родамин 6ж, родамин B) и многие другие.
Дата добавления: 2015-08-14; просмотров: 1443;
