Электронные спектры соединений
Поглощение энергии излучения в видимом и ультрафиолетовом диапазоне длин волн приводит к возбуждению обобщенных электронов в молекуле и появлению в спектре полос, соответствующих электронным переходам между различными энергетическими уровнями в молекуле, которые называют орбиталями.
Электроны в молекуле могут занимать различные орбитали. Различают следующие молекулярные орбитали (МО): s-связывающая, s*-разрыхляющая, n-несвязывающая, p-связывающая, p*- разрыхляющая. Аналогично называют электроны в органических молекулах. Так электроны, участвующие в образовании одинарных С-С связейназывают s-электронами, участвующие в образовании С=С и С≡Ссвязей – p-электронами, участвующие в образовании углерода с гетероатомами – N, O, S, галогенами, n-электронами.
Схема относительного расположения энергетических уровней, соответствующих разным МО, показана на рис.9.3.
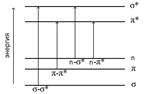
Рис.9.3 Схема электронных уровней и энергия возможных электронных переходов
Различные электронные переходы требуют неодинаковой энергии, поэтому полосы поглощения располагаются при разных длинах волн.
Наибольшей энергии требует s-s* – переход, связанный с возбуждением внутренних электронов. Он соответствует поглощению в далекой ультрафиолетовой области (l £ 200 нм, Е ³ 600 кДж/моль).  Такие переходы характерны, например, для насыщенных углеводородов. Получить спектр в этой области непросто, поскольку здесь поглощают компоненты атмосферы; по этой причине поглощение одинарной связью не имеет большого значения в аналитической практике.
Такие переходы характерны, например, для насыщенных углеводородов. Получить спектр в этой области непросто, поскольку здесь поглощают компоненты атмосферы; по этой причине поглощение одинарной связью не имеет большого значения в аналитической практике.
Переход n-s* связан уже с меньшими затратами энергии; полосы, связанные с этим переходом, расположены в обычном ультрафиолете (l ~ 200 ÷ 300 нм). Еще меньшая энергия требуется для перехода на разрыхляющие p*-орбитали. Переходы n-p* и p-p* встречаются в молекулах соединений с сопряженными связями и молекулах ароматических соединений. Такие функциональные группы, как ñС=О, ñС=Сá , –N=N–,
–N=O, ñС=S, –CºN, –CºC– и многие другие, всегда являются причиной поглощения в видимой и ультрафиолетовой областях. Их называют хромофорными группами.
Этим же переходом n-p* можно объяснить, например, интенсивную окраску ионов MnO4-и CrO42-(переход с несвязывающей орбитали кислорода). Поскольку каждое вещество характеризуется своей системой энергетических уровней, то и спектры веществ различаются как по числу полос, так и по их положению на шкале длин волн.
Полосы поглощения в спектре в УФ- и видимой областях можно зафиксировать только у тех молекул, которые имеют систему сопряженных связей. Чем больше сопряженных связей в молекуле, тем в более длинноволновой области можно зафиксировать полосы поглощения.
Очень мало неорганических молекул имеют спектры поглощения с выраженными полосами поглощения в УФ-области. К ним относятся КМnО4 и К2Cr2O7, имеющие систему подвижных электронов в атомах Мn и Cr. В видимой области полосы поглощения есть у всех окрашенных соединений, например у молекул с очень большой системой обобщенных электронов – красителей, у многих комплексных соединений, сольватов, ассоциатов.
Тонкая структура электронных спектров. Энергия, необходимая для возбуждения электронов, велика по сравнению с энергией возбуждения колебательного (и вращательного) движения атомов. Поэтому каждый электронный переход сопровождается колебательным переходом (в газовой фазе могут стать заметными и вращательные переходы). Наложение колебательных, а иногда и вращательных переходов приводит к существенному уширению полос в электронных спектрах, т.к. колебательная структура не всегда разрешается (рис. 9.4).
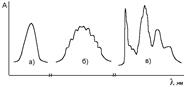
Рис. 9.4. Электронные спектры веществ: а) гладкий контур, колебательная структура не проявляется;
б) на контуре полосы видны следы колебательной структуры;
в) спектр поглощения паров антрацена с четкой колебательной структурой
В зависимости от состава молекул и условий измерения спектров (газовая или конденсированная фаза, тип растворителя, температура) полосы в электронных спектрах могут быть гладкими или характеризоваться лучше или хуже выраженной колебательной и вращательной структурами (рис.0.4); например, с увеличением полярности растворителя колебательная структура полос размывается.
Ширина полос резко увеличивается при переходе к конденсированному состоянию вещества вследствие сильного влияния соседних молекул.
Дата добавления: 2015-08-14; просмотров: 1504;
