Схема 33. Механизмы активации протоонкогенов
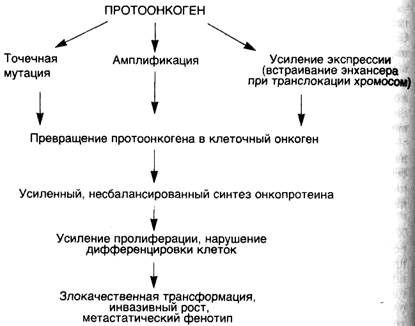
Рассматривая различные теории этиологии опухолей, поражаешься тому факту, что разнообразные канцерогенные агенты, отличающиеся по механизмам своего действия, приводят к одному и тому же результату — развитию опухолей, основными свойствами которых является нерегулируемый рост с нарушенной Дифференцировкой клеток. Объяснение этому феномену было дано лишь в последние десятилетия благодаря открытию клеточных онкогенов и антионкогенов. Современное представление о канцерогенезе связывается с возможностью различных канцерогенных агентов вызывать такие повреждения генома клеток, которые сопровождаются активацией клеточных онкогенов и/или инактивацией антионкогенов (схема 33). Связь канцерогенеза с данными генами клеток не случайна, так как именно эти гены могут запускать деление клеток, участвуют в контроле их пролиферации и дифференцировки.
В 1976 г. Stechellen и соавт. у птиц, а в 1978 г. Spector и соавт. у млекопитающих обнаружили участок ДНК, гомологичный вирусным онкогенам. В активном состоянии такие участки получили название клеточных онкогенов, в неактивном — протоонкогенов. Протоонкогены — это нормальные гены клеток. В зрелых тканях они, как правило, неактивны. Активация протоонкогенов и превращение их в клеточные онкогены происходит при опухолевом росте, а также в процессе эмбриогенеза. Некоторые из клеточных онкогенов активируются также при пролиферации и дифференцировке клеток в очагах репаративной регенерации.
Клеточные онкогены кодируют синтез белков, которые называются онкобелками, или онкопротеинами. Следует отметить, что все известные в настоящее время онкобелки принимают участие в передаче митогенетических сигналов от клеточной мембраны до ядра к определенным генам клеток. Это значит, что большинство факторов роста и других цитокинов в той или иной степени могут взаимодействовать с онкобелками.
По функциональной активности и структурному сходству с элементами сигнальной митогенетической цепочки все онкобелки могут быть подразделены на следующие группы:
▲онкобелки — гомологи факторов роста (c-sis, int-r, k-fgt и др.);
▲онкобелки — голомоги рецепторов к факторам роста (с-erB, с-егbА и др.);
▲ онкобелки, связанные с работой рецепторов, — аналоги G-белка (c-ras) и протеинкиназные белки (c-src, c-fps, c-fes, c-abl, c-met);
▲ онкобелки, передающие ростовые сигналы на ДНК (c-fos, c-jun, c-myc и др.).
Для того чтобы стимулировать пролиферацию клеток, протоонкогены должны превратиться в клеточные онкогены. Известны четыре основных механизма активации протоонкогенов:
▲инсерционная активация — активация под действием встроенных в геном генов (вирусных);
▲ активация при транслокации участка хромосомы с встроенным в него протоонкогеном;
▲ активация путем амплификации (умножении копий) протоонкогена;
▲ активация при точечных мутациях протоонкогенов (см. схему 33).
Инсерционная активация происходит при участии РНК- и реже ДНК-содержащих вирусов, которые могут встраиваться в геном клетки и своими генами модулировать активность близлежащих клеточных генов, среди которых могут оказаться протоонкогены. Ретровирусы могут быть носителями вирусного онкогена, или энхансера, выполняющего роль активатора онкогенов.
Транслокация участков хромосом в клетках может приводить к контакту протоонкогенов с сильными энхансерами, как это происходит при лимфоме Беркитта и хроническом миелолейкозе человека.
При лимфоме Беркитта наблюдается реципрокная транслокация участков хромосом 8 и 14. В результате участок хромосомы °q24, содержащий c-mic, транслоцируется на участок хромосом 14 14q32, в зону действия гена тяжелых цепей иммуноглобулинов. В Ю % случаев происходит другой вариант реципрокной транслокации с встраиванием участка 8q24, несущего c-myc в хромосому 2, вблизи генов легких цепей иммуноглобулинов. Активные гены иммуноглобулинов выступают в роли энхансеров по отношению к клеточному онкогену с-тус.
Хронический миелоидный лейкоз человека характеризуется специфическим генетическим дефектом — наличием филадельфийской хромосомы, которая образуется в результате реципрокной транслокации между хромосомами 9 и 22. Участок хромосомы 9, несущий протоонкоген c-abl, оказывается на фрагменте хромосомы 22, где формируется новый ген-гибрид c-abl-bcr, белковый продукт которого обладает тирозиназной активностью.
Амплификация клеточного онкогена проявляется в увеличении числа его копий и может захватывать как отдельные гены, так и целые участки хромосом. При этом могут появляться добавочные мелкие хромосомы. Амплификация описана для с-mус и c-ras семейств клеточных онкогенов при раке легкого, мочевого пузыря, толстой кишки, поджелудочной железы. Амплификация N-myc найдена в человеческой нейробластоме в 38 % случаев и коррелирует с плохим прогнозом жизни больных. Амплификация c-neu, онкобелок которого гомологичен рецепторам к эпидермоидному фактору роста, является плохим прогностическим фактором при раке молочной железы. Накопление в клетках карциномы онкобелка c-neu приводит к усиленному связыванию ростовых факторов, которые синтезируются самими же опухолевыми клетками (ФНО-а), что стимулирует рост опухоли по аутокринному механизму.
Антионкогены,или гены — супрессоры рака.В геноме клеток обнаруживаются гены, которые, напротив, тормозят пролиферацию клеток и оказывают антионкогенное действие. Потеря клеткой таких генов может приводить к развитию рака. Наиболее изученными антионкогенами являются р53 и Rb (retinoblastoma gene). Потеря Rb обнаруживается в редко встречаемой детской опухоли ретинобластоме (частота ретинобластомы 1 на 20 000 детей). 60 % ретинобластом развиваются спорадически, а 40 % описываются как наследственные опухоли с аутосомно-до-минантным типом наследования. В случаях наследственного дефекта Rb нормальный ген отсутствует только на одной аллеле. Вторая аллель остается сохранной, поэтому опухоль может развиться только при одновременном повреждении второго сохранного гена Rb. В случае спонтанно развившейся ретинобластомы потеря Rb затрагивает сразу оба аллеля.
Молекулой 1995 года назван ген-супрессор р53. Существуют две формы антионкогена р53: "дикая" (неизмененная) и мутированная. В опухолевых клетках при многих типах рака обнаруживается накопление мутированной или "дикой" формы р53 в избыточном количестве, что оказывает отрицательное действие на регуляцию клеточного цикла, в связи с чем клетка приобретает способность к усиленной пролиферации.
Регуляция пролиферативной активности клетки с помощью п53 осуществляется через усиление или ослабление им апоптоза (см. лекцию 8 "Некроз" общего курса). Активация р53 на фоне активации клеточных онкогенов c-fos и с-mус приводит к смерти опухолевых клеток, что и наблюдается при действии на опухоль химиопрепаратов и радиации. Мутации р53 или инактивация его другими способами на фоне усиления экспрессии c-fos, c-myc и bcl-2, наоборот, заканчиваются усилением пролиферации клеток и злокачественной трансформацией.
Дата добавления: 2015-08-14; просмотров: 2243;
