Физическое картирование ДНК по участкам узнавания эндонуклеаз рестрикции
Ферменты рестрикции стали эффективным инструментом исследования ДНК. Они позволяют превращать молекулы ДНК очень большого размера в набор фрагментов длиной от нескольких сотен до нескольких тысяч оснований. Обработка образца ДНК определенной эндонуклеазой рестрикции всегда дает один и тот же набор фрагментов — при условии, что расщепление происходит по всем сайтам узнавания. Если использовать несколько ферментов рестрикции и сначала обработать ДНК каждой из выбранных ферментов в отдельности, а затем их комбинациями, можно построить физическую карту данной ДНК, т. е. установить порядок расположения сайтов рестрикции вдоль молекулы. Определив размер полученных фрагментов с помощью гель-электрофореза, можно найти положение рестрикционных сайтов.
С помощью метода электрофореза в агарозном геле фрагменты ДНК, различающиеся по размеру, можно легко разделить, а затем исследовать каждый фрагмент отдельно (рис 3).
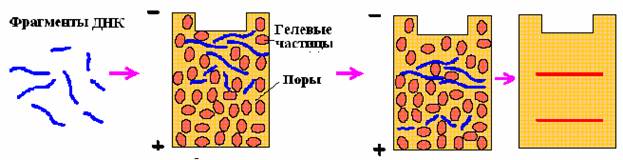
Рис. 3. Схема фракционирования фрагментов ДНК по размерам методом гельэлектрофореза
Короткие фрагменты мигрируют намного быстрее, чем длинные. При сравнительно высокой концентрации агарозы большие фрагменты вообще не могут проникнуть в гель. В процессе миграции рестрикционные фрагменты не деградируют, их можно элюировать (вымывать) в виде биологически активных двуцепочечных молекул. При окрашивании гелей красителями, связывающимися с ДНК, выявляется набор полос, каждая из которых отвечает рестрикционному фрагменту, молекулярную массу которого можно определить, проведя калибровку с помощью ДНК с известными молекулярными массами.
Пример. На рисунке 4А приведена схема распределения в геле фрагментов рестрикции и указаны размеры фрагментов, полученных в результате расщепления линейного участка какой-то условной ДНК эндонуклеазами ЭР1, ЭР2 и их смесью. Исходя из числа фрагментов ДНК, представленных на дорожках ЭР1 и ЭР2 видно, что данный участок ДНК имеет по два сайта рестрикции для каждой из них. Чтобы построить карту взаимного расположения этих сайтов на данном участке ДНК, следует сравнить размеры фрагментов, полученных при раздельной рестрикции и при рестрикции смесью ферментов. Результат такого сравнения представлен на рис. 4Б.
Если при гидролизе ДНК каждой из двух эндонуклеаз (ЭР1 и ЭР2) образуются три фрагмента, значит, в исходном фрагменте ДНК было два сайта узнавания для каждой из них. Фрагмент размером 300 п. н,, который образуется в результате гидролиза ЭР1, не расщепляется при гидролизе смесью ЭР1 и ЭР2в отличие от ЭР1-фрагментов размером 850 и 500 п. н. Значит, два ЭР1-сайта находятся на расстоянии 300 п. н. друг от друга и между ними нет ЭР2-сайта, а в ЭР1-фрагментах длиной 850 и 500 п.н. есть по одному ЭР2-сайту. Фрагмент размером 950 п. н., который образуется при обработке ДНК рестриктазой ЭР2, при двойном гидролизе расщепляется ЭР1 на три фрагмента (250+300+400 - 900 п.н.). Значит, два ЭР2-сайта находятся на расстоянии 250 и 400 п. н. по разные стороны от сайтов для ЭР1. ЭР2расщепляет ЭР1-фрагмент длиной 850 п. н. на фрагменты длиной 250 и 600 п, н., а один из сайтов для ЭР1находится на расстоянии 250 п. н. от сайта для ЭР2,значит, фрагмент 600 п. н. должен содержать один из концов исходной молекулы ДНК. Далее, видно, что ЭР2расщепляет ЭР1-фрагмент длиной 500 п. н. на два фрагмента размером 100 и 400 п. н. и что один из ЭР1-сайтов отделен от ЭР2-caйтa 400 п. н.; значит, фрагмент длиной 100 п. н, должен располагаться на другом конце исходной молекулы. Таким образом, на рисунке 4Б представлена физическая карта линейного участка условной ДНК по участкам рестрикции ЭР1 и ЭР2.
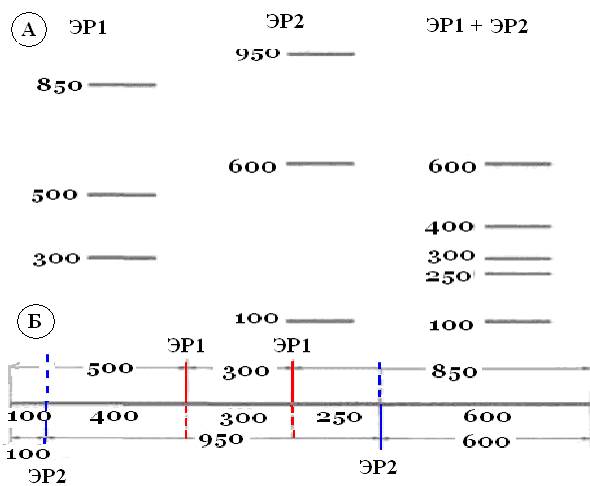
Рис. 4. Картирование сайтов рестрикции.
АСхема распределения фрагментов ДНК, полученных при гидролизе эндонуклеазами рестрикции. Очищенную ДНК гидролизовали рестриктазами ЭР1и ЭР2раздельно, а затем их смесью, проводили гель-электрофорез и визуализировали продукты окрашиванием бромистым этидиемРазмер фрагментов ДНК указан в парах нуклеотидов.
БРестрикционная карта, построенная по электрофоретическим данным.
Повторив подобные эксперименты на одной и той же ДНК, но с другими эндонуклеазами рестрикции, можно получить более подробную карту, где отмечено много сайтов рестрикции, а, значит, существует реальная возможность направленно работать с определенными участками молекул исследуемых ДНК. Таким образом, рестрикционные карты способствуют функциональному картированию ДНК
Располагая такой информацией, можно идентифицировать на ДНК биологически важные участки. Поскольку рестрикционная карта отражает расположение определенной последовательности нуклеотидов в данном участке, сравнение таких карт для двух или более родственных генов позволяет оценить гомологию между ними. Анализируя рестрикционные карты, можно сравнивать определенные участки ДНК разных видов животных без определения их нуклеотидной последовательности. Таким образом, например, было установлено, что хромосомные участки, кодирующие цепи гемоглобина у человека, орангутанга и шимпанзе сохранились в практически неизменном виде в течение последних 5 - 10 млн. лет (с тех пор как виды дивергировали).
Метод рестрикционного картирования позволяет увидеть крупные генетические изменения, такие как делеции или инсерции. При этом происходит уменьшение или увеличение рестрикционных фрагментов, а также исчезновение или возникновение сайтов рестрикции.
Один из приемов картирования – фингерпринт (“метод отпечатков пальцев” или DNA-fingerprint). Он подразумевает использование неупорядоченных и неполных наборов фрагментов, которые являются характеристикой генома, хотя описывает его не полностью.
Необходимо также отметить, что рестрикционный анализ ДНК и рестрикционные карты взаиморасположения сайтов узнавания и рестрикции для разных эндонуклеаз лежат в основе одного из самых распространенных методических подходов молекулярной генетики: исследование полиморфизма длин рестрикционных фрагментов (ПДРФ). Этот вид анализа последовательностей ДНК используется как в фундаментальных исследованиях различных геномов так и для прикладных целей: например в ДНК-диагностике наследственных болезней человека.
И, наконец, расщепление рестрицирующими эндонуклеазами имеет еще одно применение. Когда два разных образца ДНК обрабатывают одной и той же эндонуклеазой рестрикции с образованием фрагментов с липкими концами, а затем смешивают эти образцы, то благодаря комплементарному спариванию липких концов фрагментов разных образцов могут образовываться новые комбинации генов - рекомбинантные ДНК (рис. 5).
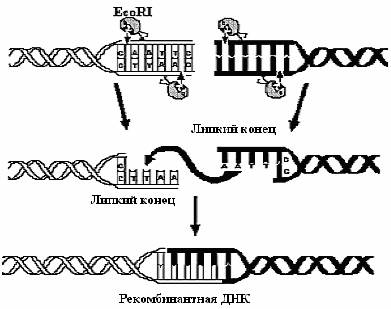
Рис. 5. Применение эндонуклеазы рестрикции EcoRI для создания рекомбинантной ДНК
Следует отметить, что рекомбинантные ДНК можно получать также и при объединении фрагментов ДНК с тупыми концами, что будет рассмотрено в другом разделе пособия. Однако, для осуществления молекулярного клонирования недостаточно одних только ферментов рестрикции.
Фосфомоноэстеразы.Эти ферменты относятся к фосфатазам и отщепляют как 5’-, так и 3’-концевые фосфомоноэфирные группы в ДНК и РНК.
Полинуклеотидкиназа. Это еще один фермент, модифицирующий полинуклеотидные цепи. Он является фосфотрансферазой, которая специфически фосфорилирует 5’–концевые гидроксильные группы молекул ДНК и РНК. Полинуклеотидкиназу используют для получения радиоактивномеченых зондов. Фермент обеспечивает введение радиоактивной метки с 5’-конца полинуклеотидной цепи с помощью изотопа P32 в составе АТФ, меченой по γ–фосфату. Последовательное действие фосфатазы и полинуклеотидкиназы приводит к замещению немеченого 5’–концевого фосфомоноэфира на радиоактивный без каких-либо других изменений в цепи.
Лигазы
Лигазы (лат. ligare – сшивать, соединять) – это ферменты, катализирующие соединение двух молекул с образованием новой химической связи (лигирование). В молекулярной биологии лигазы разделяют на две большие группы: ДНК-лигазы и РНК-лигазы.
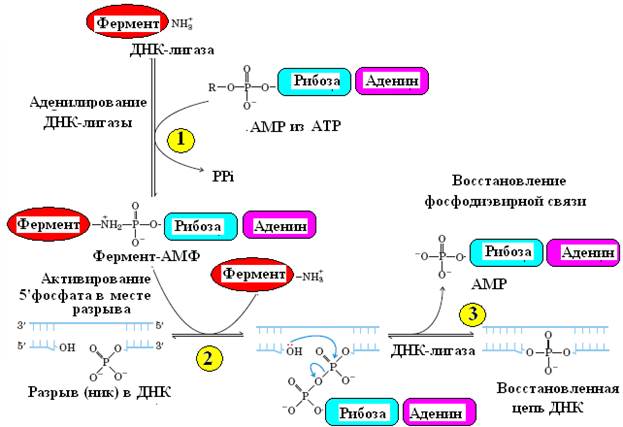
Рис. 6. Схема механизма действия ДНК-лигазы
ДНК-лигазы катализируют ковалентное сшивание цепей ДНК в дуплексе (рис. 6). Они образуют фосфодиэфирные мостики между 5’-фосфатной и 3’- гидроксильной группами соседних дезоксинуклеотидов в местах разрывов ДНК или между двумя молекулами ДНК. Для образования этих связей лигазы используют энергию гидролиза АТФ.
В 1961 г. Мезельсон и Вейгл на примере фага l показали, что рекомбинация включает разрыв и последующее воссоединение молекул ДНК. Это положило начало поискам фермента, участвующего в сшивании фрагментов ДНК. В 1967 году такой фермент был найден и получил название ДНК-лигаза. В биологических системах in vtvo ДНК-лигазы абсолютно необходимы в процессах репликации, репарации и рекомбинации.
В генной инженерии используют два типа ДНК-лигаз, отличающихся по потребностям в кофакторах и способу действия. ДНК-лигаза E. coli в качестве кофактора использует дифосфопиридиннуклеотид, а лигаза фага Т4 - АТФ в присутствии Mg2+. Лигаза фага Т4 более универсальна, так как помимо лигирования липких концов способна катализировать реакцию воссоединения двухцепочечных фрагментов ДНК с тупыми концами. Она используется чаще.
Дата добавления: 2015-07-14; просмотров: 1885;
