Межвидовые пересадки эмбрионов и получение химерных животных
Принято считать, что успешная пересадка эмбрионов может быть осуществлена только между самками одного вида. Пересадка эмбрионов, например, овец козам и наоборот сопровождается их приживляемостью, но не завершается рождением потомства. Во всех случаях межвидовых беременностей непосредственной причиной абортов является нарушение функции плаценты, по-видимому, за счет иммунологической реакции материнского организма на инородные антигены плода. Эта несовместимость может быть преодолена получением химерных эмбрионов с помощью микрохирургии.
Сначала были получены химерные животные путем объединения бластомеров из эмбрионов одного вида. С этой целью получали сложные химерные эмбрионы овец объединением 2-, 4-, 8-клеточных эмбрионов. Каждый сложный объединенный эмбрион состоял из равного числа бластомеров эмбрионов от 2—8 родителей. При этом общее число клеток колебалось от четырех- до восьмикратного увеличения нормального числа клеток. Эмбрионы вводили в агар и переносили в лигатированные яйцеводы овец для развития до стадии ранней бластоцисты. Нормально развивающиеся бластоцисты пересаживали реципиентам и получили живых ягнят, большинство из которых оказались химерными по данным анализа крови и внешним признакам.
Получены химерные овцы путем инъекций внутренней клеточной массы, выделенной иммунохирургическим путем из эмбрионов доноров в бластоцисты эмбрионов реципиентов. Зону пеллюциду у бластоцист доноров удаляли инкубированием в 0,5 %-ной проназе и пипетированием.
Для восстановления их функции после обработки проназой эмбрионы культивировали в течение 3 ч. Затем эмбрионы без прозрачной оболочки культивировали в течение 1 ч в антисыворотке к клеткам печени овцы, три раза отмывали и помещали в раствор (1:4) сыворотки крови морской свинки на 1 ч. Лизированные клетки трофобласта удаляли пипетированием, а изолированную внутреннюю клеточную массу вводили проколом инъекционной пипетки через зону пеллюциду в трофобласт бластоцисты реципиента. После пересадки этих бластоцист получены химерные ягнята как по признакам групп крови, так и по внешним признакам.
Получены химеры и у крупного рогатого скота (Г. Брем и др., 1985) соединением половинок 5—6,5-дневных эмбрионов. Пять из семи телят, полученных после нехирургической пересадки агрегированных эмбрионов, не имели признаков химеризма. Один теленок был химерой двух по-
 род — бурой швицкой и голштинофризской. Однако масть бурой швиц-кой породы доминировала. Анализ крови этого теленка показал присутствие групп крови только от родителей голштинофризской породы. Другой теленок был химерой неопределенного происхождения.
род — бурой швицкой и голштинофризской. Однако масть бурой швиц-кой породы доминировала. Анализ крови этого теленка показал присутствие групп крови только от родителей голштинофризской породы. Другой теленок был химерой неопределенного происхождения.
Показана высокая эффективность получения химер крупного рогатого скота объединением морул без зоны пеллюциды. Авторы получили химеры крупного рогатого скота с «двойной мускулатурой». В этих исследованиях показано, что передача химерам родительского типа имеет случайный характер, т. е. потомство может развиваться из клеток, происходящих или от любого эмбриона, или от сочетания эмбрионов. Половина всех химер представляет собой интерес.
Наиболее показательно получение химер от объединенных частей эмбрионов разных видов, например, овцы и козы.
Исследования СВ. Фехилли и др. (1984) показали, что бластомеры овцы и козы, заключенные в агар и помещенные на 4—5 сут в лигатиро-ванный яйцевод овцы, могут формировать комбинированные бластоци-сты. Эти бластоцисты жизнеспособны и могут развиваться до рождения нормального потомства. В первом опыте в результате объединения по одному бластомеру из 4-клеточных эмбрионов овцы и козы получено 17 бластоцист, пересадка которых завершилась получением семи потомков. Все потомки были похожи в основном на ягнят, но у трех из них руно имело поперечные валики и лоскуты волос, резко контрастирующие с плотно вьющейся шерстью.
" 5.2.4. Клонирование животных
Число потомков от одной особи, как правило, у высших животных бывает небольшим, а специфический комплекс генов, определяющий высокую продуктивность, возникает редко и в последующих поколениях претерпевает значительные изменения.
Вместе с тем известно, что ядро соматической клетки обладает полной генетической информацией о данном организме, и если создать условия для реализации этой информации, то можно получить практически неограниченное число генетических копий (клонов) определенной особи. Поскольку ядра большинства соматических клеток находятся в дифференцированном состоянии, то эту задачу на первом этапе решали, используя эмбриональные клетки на определенной стадии развития зародыша, когда еще не произошла их дифференциация. Пересадка ядер (бластомеров) в зрелые ооциты дает такую возможность, потому что цитоплазма ооцитов содержит специфические факторы, способные репро-граммировать пересаженное ядро и запускать программу развития нового эмбриона.
Получение однояйцовых близнецовимеет большое значение для животноводства. С одной стороны, увеличивается выход телят от одного 216
донора, а с другой — появляются генетически идентичные двойни. Получение идентичных двоен в большом количестве могло бы облегчить оценку быков по качеству потомства, уменьшить стоимость спермопро-дукции, ускорить и удешевить тестирование препаратов и упростить исследования в области кормления животных.
Возможность микрохирургического разделения эмбрионов млекопитающих на ранних стадиях развития на две и более части, чтобы каждая в последующем развивалась в отдельный организм, была высказана несколько десятилетий назад. Первое потомство однояйцовых мышей было получено из механически изолированных бластомеров двухклеточных эмбрионов в 1970 г. Используя ту же технику разделения, но с применением метода заключения в агар, СМ. Вилладсен (1979) описал получение однояйцовых двоен у овец разделением 2-клеточных эмбрионов. Последующие эксперименты показали, что одинаковые двойни могут быть также получены из 4- и 8-клеточных эмбрионов разделением бластомеров на две группы (СМ. Вилладсен, 1980). Половинки из 2-, 4- и 8-клеточных эмбрионов так же жизнеспособны, как и нормальные эмбрионы овец. Их можно хранить в замороженном состоянии, что позволило применить их в эксперименте для получения монозиготных двоен разного возраста.
Выживаемость четвертей эмбрионов клетки или 8-клеточных эмбрионов на четыре пары клеток ниже, чем нормальных. Выживаемость эмбрионов, полученных из отдельных бластомеров 8-клеточных эмбрионов, почти нулевая.
Установлено, что бластоцисты, полученные из половинок эмбрионов, состоят из 32 клеток, т. е. составляют лишь 50 % нормального числа клеток. Отдельные бластомеры из 4-клеточного эмбриона также способны развиться в бластоцисту. Однако бластоциста из такой четверти состоит из 16 клеток и меньше.
На 8-клеточной стадии каждый бластомер имеет потенциальную возможность развиваться в бластоцисту, но очень маленького размера, примерно из восьми клеток. При пересадке таких бластоцист менее 10 % из них развиваются до стадии рождения.
На основе этих исследований можно предположить, что резкое уменьшение числа клеток эмбриона является основным фактором, понижающим способность этих эмбрионов развиваться в жизнеспособные бластоцисты, хотя стадия развития, на которой происходит разделение, имеет малое значение.
После того как для эмбрионов большинство животных заканчивается компактизация морулы, защита со стороны зоны пеллюциды становится несущественной. Поэтому последующие разработки по получению монозиготных двоен были направлены на использование поздних морул и бластоцист.
В настоящее время применяют простую технику разделения эмбрионов на различной стадии развития (от поздней морулы до вылупившейся
 бластоцисты) на две равные части одновременно с разрезом зоны пеллю-циды. При этом не выявлена существенная роль присутствия зоны пел-люциды для эффективности развития разделенных бластоцист.
бластоцисты) на две равные части одновременно с разрезом зоны пеллю-циды. При этом не выявлена существенная роль присутствия зоны пел-люциды для эффективности развития разделенных бластоцист.
Использование эмбрионов на более поздних стадиях развития у крупного рогатого скота для получения однояйцовых близнецов облегчается тем, что их извлекают нехирургическим способом.
Простая техника разделения разработана и для 6-дневных эмбрионов свиней. При этом стеклянной иглой разрезают внутреннюю клеточную массу эмбриона и примерно 40 % зоны пеллюцида. Затем разрезают слой трофоэктодермы внутри зоны пеллюциды. Одну половинку эмбриона в собственной зоне пеллюциды, а другую без зоны пеллюциды пересаживают в рог матки 6-дневного реципиента на расстоянии 5 см от маточ-но-трубного соединения.
Техника разделения на половинки эмбрионов успешно применяется на овцах и на козах.
Деление на стадии поздней бластоцисты считается более удобным, так как блестящая оболочка тоньше и цитоплазма эластичнее, чем у ранней бластоцисты.
При разработке оптимальных условий получения монозиготных близнецов большое внимание уделялось продолжительности культивирования in vitro после разделения и трансплантации половинок эмбрионов, а также их хранению в замороженном состоянии.
Установлено, что продолжительность культивирования половинок эмбрионов более 4 ч снижает результативность их последующей приживляемое™. Культивирование in vitro половинок эмбрионов крупного рогатого скота в течение 24 ч снижает их приживляемость примерно в три раза по сравнению с культивированием in vitro в течение 4—6 ч.
Разделенные эмбрионы коров могут храниться в замороженном состоянии.
Клонирование эмбрионов путем пересадки ядер эмбриональных клеток в энуклеированные яйцеклетки.После пересадки ядер эмбриональных клеток в энуклеированные яйцеклетки ядро репрограммируется таким образом, что начинает развиваться новый эмбрион. Теоретически все бластомеры из эмбриона донора имеют одну и ту же генетическую основу и, таким образом, способны обеспечить развитие идентичных особей. Эмбрионы, развившиеся после пересадки ядер, в свою очередь, могут быть использованы как доноры ядер. После нескольких генераций создается возможность получения сотен и даже тысяч идентичных эмбрионов.
Клонирование эмбрионов путем пересадки ядра включает три основных этапа: выделение интактного ядра донора, энуклеацию ооцита, пересадку ядра в энуклеированную яйцеклетку. В отличие от амфибий пересадка ядра у млекопитающих не стимулирует ооцит. Поэтому требуется четвертый этап — активация ооцита и слияние мембран яйца и ооцита. 218
Под действием электрического импульса происходит активация ооцита и слияние мембран между ядром клетки донора и энуклеированным ооци-том-реципиентом. Технология пересадки ядер клетки способствовала успешному получению клонированных живых кроликов, мышей, овец, коз, крупного рогатого скота и свиней. Было показано, что только эмбрионы на предимплантационной стадии являются тотипотентными, но эффективность этой технологии пока низка. У крупного рогатого скота была продемонстрирована следующая эффективность этой технологии на каждом этапе (%): энуклеация — 70—80, развитие морулы-бластоцисты клонированных эмбрионов — 20—30. В исследованиях К.Р. Вондиоли (1991) 190 эмбрионов с пересаженными ядрами были получены из одного эмбриона путем многократной пересадки ядер из последовательно клонированных эмбрионов. Однако последовательные пересадки ядер после четвертого цикла сопровождались высокими эмбриональными потерями в матке. В итоге не удалось получить телят от пересадки эмбрионов, полученных после третьего цикла клонирования.
При использовании в качестве доноров ядер более продвинутых в развитии эмбрионов крупного рогатого скота 6-дневного возраста (47—68 бластомеров), по сравнению с использованием малоклеточных эмбрионов того же возраста (около 30 бластомеров), достигается более высокая эффективность слияния бластомера и ооцита, дробления эмбрионов и развития до стадии бластоцисты (В.И. Захарченко и др., 1996). Эффективность развития клонированных эмбрионов крупного рогатого скота выше при использовании в качестве источника бластомеров морул на стадии прекавитации. При этом свежевымытые морулы являются лучшими донорами ядер, чем развившиеся in vitro.
Осложняет пересадку ядер эмбриональных клеток получение телят с большой живой массой примерно на 15—30 % больше, чем у контрольных животных. Это приводит к тяжелым родам (рождение мертворожденных телят, задержке выхода последа).
Пересадка ядер эмбриональных клеток в энуклеированные яйцеклетки имеет много преимуществ по сравнению с технологией разделения эмбрионов. Эти преимущества следующие: отдельные эмбриональные клетки, полученные из эмбриона на стадии до 64 клеток, могут быть ре-программированы в одноклеточные зиготы и давать множественные копии генетически одинаковых животных; повторное клонирование путем пересадки ядер от клонированных эмбрионов повышает потенциальные возможности технологии в производстве большего числа клонов.
Клонирование животных путем пересадки ядер соматических клеток в энуклеированные яйцеклетки.Накопленный опыт клонирования эмбрионов путем пересадки ядер тотипотентных клеток из эмбрионов в энуклеированные яйцеклетки послужил базой для разработки метода клонирования животных путем пересадки ядер соматических клеток в энуклеированные яйцеклетки. Принципиальное отличие состоит в том,
Ill
что клонирование путем пересадки ядер эмбриональных клеток обеспечивает получение идентичных животных между собой, тогда как пересадка ядер соматических клеток взрослого животного обеспечивает получение не только одинаковых между собой животных, но и идентичных по генотипу с животным-донором соматических клеток. Это открывает возможность получать неограниченное число генетически идентичных потомков уже в первом поколении. Нет необходимости объяснять, насколько революционным может быть этот прием в селекции и разведении сельскохозяйственных животных.
Возможность получения клонов животных с использованием ядер соматических клеток была впервые продемонстрирована в 1977 г. получением овцы Долли (Wilmul et al., 1997). Вильмут с коллегами трансплантировали ядра клеток молочной железы в энуклеированные яйцеклетки овцы.
С этого момента работы многих лабораторий мира была направлена на исследование способности репрограммирования клеток плода и взрослого животного.
Talbot et al. (1998) получили культуру фетальных фибропластов 100-дневного плода коровы и использовали для трансплантации ядер. Получены четыре стельных реципиента (7 %), которые впоследствии абортировали.
Heyman et al. (1998) получили двух телят из клонированных эмбрионов с ядрами фибропластов, взятых на мышцы и кожи плода. Однако эффективность развития клонированных эмбрионов до стадии бластоцисты была очень низкой (3—8 %).
В опытах Zakhartcheto et al. (1999) эпителиальные клетки молочной железы и фибробластно-подобные клетки уха были получены от 2—3-летних симментальских коров и культивировались в среде ДМЕМ с 10 %-ной фетальной сывороткой теленка. После одного-пяти пассажей концентрация фетальной сыворотки уменьшалась с 10 до 0,5 % в течение 4—6 дней, чтобы вызвать голодание. Созревание ооцитов проводили по обычной методике (Stojkovic et al., 1995). Комулюсные клетки удаляли через 18—20 ч после созревания путем микропипетирования или обработкой гиалуронидазой. Ооциты с полярным тельцем энуклеировали путем удаления минимального цитоплазматического объема. Через 20—22 ч отдельные донорские клетки сливали с энуклеированными ооцитами, используя двойной электрический импульс, 2,1 kv/см в течение 10 с. Через 24 ч слившиеся кариопласт-цитопласт комплексы активировались 5-минутной инкубацией в 7 %-ном этаноле с последующим 5-часовым культивированием в 10 мкг/мл цитоксимида и 5 мкг/мл цитохалазина В. Конструированные эмбрионы культивировали в среде CRJ (Rosenkrans a. First, 1991) с добавкой 10 %-ной эстральной сыворотки коровы в течение 7 дней. . „■>■,. , ь. : •..... : ,. ... ...к-. ,. .. , . ■ , ■.,, .:
Таблица 5.5. Развитие in vitro эмбрионов с пересаженными ядрами, полученными из клеток взрослых животных (по Zakharteheto et al., 1999)
| Клетки доноры | Слилось, % | Дробилось, % | Бластоцист, % | Вылупившихся бластоцист, % |
| Клетки молочной железы Клетки из уха Раб < 0,05 | 93/147(63) 177/244(73) | 65(70) 135(76) | 32(34)" 92(52)6 | 23(25)" 84(48)6 |
После пересадки бластоцист, полученных из клеток молочной железы и уха, соответственно 100 % (2/2) и 42 % (5/12) исследованных реципиентов были беременны на 42-й день. Во время публикации два реципиента имели беременность более 4 месяцев (клетки молочной железы) и пять реципиентов — от 1,5 до 3 месяцев (клетки из уха) (табл. 5.5). Результаты показывают, что взрослые клетки крупного рогатого скота могут быть успешно использованы для пересадки ядер, но клеточные линии, используемые в этих исследованиях, отличаются по потенциальным возможностям и развитию. Различия в способности быть программированными, наблюдаемые с этими двумя линиями клеток могут быть из-за их импринтинга (отпечатка) или модификации хроматина.
Целью исследований Wells et al. (1999) было проклонировать последнюю оставшуюся островную корову в Исландии на острове Индерби с целью сохранения генетики самок этой эндогенной породы крупного рогатого скота, приспособленного к субтропическим условиям. Несмотря на то что семя от девяти уже не живущих быков было заморожено, попытки в последние шесть лет добиться воспроизводства у этой коровы завершились рождением одного бычка, который был получен в результате оплодотворения in vitro прижизненно извлеченных ооцитов. Качество яйцеклеток этой коровы было низкое, возможно связанное с ее возрастом (13 лет) или генетикой. Поэтому клонирование взрослого животного, возможно, являлось единственным приемом получения самок, которые потом могут быть осеменены семенем исландского быка и создания возможности дальнейшей племенной работы с этой породой.
Клеточная линия была получена из гранулезных клеток, собранных путем аспирации фолликулов, используя ультразвуковой прибор. Клетки культивировали в OMEM/F12, содержащей 10 % фетальной сыворотки, и использовали для пересадки ядра между 4 и 8 пассажами. Донорские клетки были индуцированы голоданием сыворотки крови в течение 9—23 дней и подвергнуты электрическому слиянию с энуклеированными ооцитами, полученными после созревания in vitro.
Реконструированные эмбрионы затем активировали и стимулировали одновременно слиянием. Слившиеся эмбрионы культивировали в SOFa BSA и бластоцисты пригодного качества пересаживали по паре синхронизированным реципиентам коровам через 7—8 дней после охоты.
После пересадки 74 эмбрионов, выживаемость эмбрионов на 30, 55 и 150 дни была 38, 30 и 23 %, соответственно. Из первых пересаженных 22 эмбрионов, родились два теленка. Однако один пал через два дня. Выживший теленок здоров. Микросателлитный анализ ДНК подтверждает, что телята являются генетически идентичными с островной коровой Ин-дерби. Дополнительные беременности развиваются.
Эти данные показывают, что развитие эмбрионов увеличивается в результате пролонгированного действия голодания ядер соматических клеток с цитоплазмой ооцита перед искусственной активацией, возможно облегчая ядерное ремоделирование и репрограммирование. Кроме того, дивалентные катионы улучшали степень электрического слияния клеток.
Корейские ученые использовали в качестве доноров ядер фетальные фибробласты (от плодов 60—70-дневного возраста). Линии клеток культивировали, по меньшей мере, 7 пассажей. Эти клетки фибробласты, были определены нормальными по результатам хромосомного анализа (окрашивание 5 %-ной гимзой). Клетки были простимулированы голоданием сывороткой крови в течение 4—5 дней до пересадки ядер. Все манипуляции проводили при комнатной температуре в течение 3 ч в конце созревания in vitro. Созревшие in vitro ооциты были энуклеированы после 22 ч созревания. Энуклеация была подтверждена под ультрафиолетом после 10 мин инкубации с 5 мг/мл Hochest 33342. Реконструированные эмбрионы помещали в камеру для слияния в 0,28 М раствора манитола. Одиночный электрический пульс 1,75 kv/см в течение 20 ms применялся для одновременного слияния клеток и активации оопласта. Слившиеся клетки культивировали в течение 1 ч в 5 мг/мл цитохалазина В. Успешно слившиеся эмбрионы помещали в TALP, содержащий 4 мг/мл БСА без жирных кислот для культивирования in vitro эмбрионов, развившихся до компактной морулы.
Реконструированные эмбрионы успешно сливались (50/67; 77,8 ± 13,4 %), дробились (26/50; 55,3 ±21,5 %) и развивались до морулы/бластоцисты (11/26; 44,3 + 13,8 %). В предварительном исследовании две из вылупившихся бластоцист были окрашены 5 %-ной гимзой для подсчета клеток. В одной было 100, а в другой 70 клеток. 11 компактных морул, или бластоцист, были пересажены девяти реципиентам. Четыре реципиента были беременными (44,4 %), подтверждено ультразвуком на 40—50-й день. Один реципиент абортировал на 60-й день, а у других беременность продолжается.
Начиная с конца 80-х и в течение 90-х годов проводились широкие исследования по изучению возможности репрограммирования герминативных клеток млекопитающих.
Stewart et al. (1994) получили линию эмбриональных герминатив
ных клеток, которые имели характеристики эмбриональных стволовых
клеток, и использовали эти клетки при создании химер. Причем клетки с
геномом этой клеточной линии обнаруживались в популяции половых
клеток. ;.i.., • . -. , • ■ ■■ • '■ • ■ ■■ ■ ■-

|
V
Л
•♦«*'
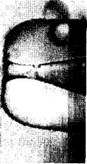
Рис. 5.3. Соматические клетки (фетальные фибробласты), используемые
для клонирования кроликов ,
Однако первые эксперименты по трансплантации ядер герминативных клеток млекопитающих были мало эффективны. Лишь 1,6—16,3 % реконструированных эмбрионов развивались до стадии бластоцисты (Delhaise et al., 1997; Heiman et al., 1998; Tsunoda et al., 1998). У кроликов клонированные эмбрионы не имплантировались (Moens et al., 1996). У мышей имплантировались, но не развивались до рождения потомства (Tsunode et al., 1989; Kato, Tsunoda, 1995). У коров реконструированные эмбрионы имплантировались, но на ранних стадиях развития (до 40 дней) беременность прекращалась (Delthaise et al., 1995; Moens et al., 1996; Laveir et al., 1997).
Однако в 1998 г. на конференции «Генетическая инженерия и клонирование животных» в штате Юта (США) Stelchenko et al. (1998) доложили о рождении теленка, полученного методом трансплантации ядер герминативных клеток герминативной складки плода коровы 40—45-дневного возраста.
Исследователи использовали не свежевыделенные герминативные клетки, а после продолжительного культивирования, а также применили реклонирование первоначально полученных морул.
Zakharteheto et al. (1999) использовали свежевыделенные герминативные клетки для трансплантации ядер в неактивированные оопласты. В результате развитие клонированных эмбрионов до стадии бластоцисты достигло 38 % и завершилось получением телят.
 | |||
 | |||
 В наших экспериментах у кроликов ядра фе-тальных фибробластов репрограммировались и обеспечивали развитие эмбрионов до стадии бла-стоцистов с высокой эффективностью — 51 % (Galat et al., 1999) (рис. 5.4, 5.5, 5.6, 5.7).
В наших экспериментах у кроликов ядра фе-тальных фибробластов репрограммировались и обеспечивали развитие эмбрионов до стадии бла-стоцистов с высокой эффективностью — 51 % (Galat et al., 1999) (рис. 5.4, 5.5, 5.6, 5.7).
| ■. B'wl Рис. 5.4. Неоплодотворенная яйцеклетка кролика с направительным тельцем |
В Биотехцентре РАСХН показаны различия в эффективности репрограммирования фибропластов, взятых из плода и взрослого кролика.
Фетальные фибробласты в качестве доноров ядер для трансплантации в энуклеированные яйцеклетки были использованы и в работе со свиньями Du et al. (1999).
Собирали ооциты от суперовулировавших
свиней-доноров через 50—54 ч после инъекции ХГ и удаления кумулюса пипетированием и обработкой гиалуронидазы. Ооциты активировали и сливали одновременно через 54—56 ч, используя два повтора ВС пульсов (1,5 kv/см, 60 мкс х 2) с интервалом 30 мин с применением 0,3 М раствора маннитола, содержащего 0,1 тМ СаС12, 0,1 тМ MgSO4 и 0,01 % PVA. Фибробласты получали от 25-дневных плодов и культивировали в ДМЕМ плюс 10 % фетальной сыворотки. Клетки с 3—5 пассажами были подвергнуты голоданию при культивировании в течение 5 дней с 0,5 % фетальной сыворотки. Эмбрионы с пересаженными ядрами культивировали в течение 7 дней с 10 % фетальной сывороткой, добавленной на 96 ч. Эффективность развития очень низкая.
Аналогичная, низкая эффективность развития до стадии бластоцисты была в опытах Tao et al. (1999) — до 7%.
Таким образом, в настоящее время показано, что к репрограммирова-нию и обеспечению развития до стадии бластоцисты способны многие клетки взрослого организма: фибробласты (кролик — Mitalipov et al.,
|

|
I
Рис.5.5. Энуклеация: удаление ядерного материала ич яйцеклетки кролика

Рис.5.6. Клонированные бластоцисты кролика, полученные в результате пересадки ядер соматических клеток в энуклеированные яйцеклетки (Биотехцентр, РАСХН)
1998; Dinnyes et al., 1999; Lagutina et al., 1999; корова — Zakhartchenko et al., 1999; Vignon et al., 1999), клетки эпителия молочной железы (овца — Wilmut et al., 1997; Zakhartchenko et al., 1998, 1999), гранулезные клетки (мышь — Wakayama et al., 1998; корова — Collas, Barnes, 1994; Kato et al., 1998; Wells et al., 1999), клетки эпителия яйцевода (корова — Kato et al., 1998); клетки Сертоли и нейрональные клетки (мышь — Wakayama et al., 1998). Однако потомство получено только при трансплантации ядер клеток эпителия молочной железы (овца — Wilmut et al., 1997; корова — Zakharteheto et al., 1999), фибробластов (корова — Zakharteheto et al., 1999; Vignon et al., 1999), гранулезных клеток (мышь — Wakayama et al., 1998; корова — Kato et al., 1998; Wells et al., 1999) и клеток эпителия яйцевода (корова — Kato et al., 1998).
Успешная демонстрация пересадки ядер соматических клеток у животных расширяет возможности применения этой технологии для решения новых задач в области воспроизводства и селекции сельскохозяйственных животных. При использовании удобных источников ооцитов и суррогатных самок эта технология может быть использована для сохранения других исчезающих пород животных, подобно тому, как это было продемонстрировано для сохранения эндогенной породы крупного рогатого скота, приспособленного к субтропическим условиям в Исландии (Wells et al. 1999), и будет способствовать разработке метода внутривидовой пересадки ядер клеток в будущем.
 Использование этой технологии открывает большие возможности в повышении эффективности получения трансгенных животных, и биомедицине.
Использование этой технологии открывает большие возможности в повышении эффективности получения трансгенных животных, и биомедицине.
Резюмируя накопленные данные по клонированию животных,можно отметить, что успех развития реконструированных эмбрионов в значительной степени обеспечивается согласованием стадии клеточного цикла донора ядер и цитоплазмой реципиента. Неадекватный выбор фазы клеточного цикла реципиента или донора во время реконструкции может привести к разрушению ДНК и неправильной плодии реконструированного эмбриона. Взаимосвязи между ядром донора и цитоплазмой реципиента происходят на многочисленных уровнях, которые в настоящее время изучаются. Установлено, что синхронизация отдельных бластомеров на ранней стадии развития является полезным инструментом для изучения взаимосвязи клеточных циклов у разных видов животных, включая кроликов (Collas P. et al., 1992), крупный рогатый скот (Campbell et al., 1993) и мышей (Otaegu P.J. et al., 1994). Синхронизация бластомеров на Gl/S-фазе и пересадка в ооциты на МII повышают эффективность развития эмбрионов у многих видов животных, включая кроликов (Collas P. et al., 1992) и крупный рогатый скот (Tanaka H. et al., 1995). Однако в качестве рутинного метода для клонирования эмбрионов эта техника недостаточно надежна, так как во время раннего развития в любой период времени большинство ядер в эмбрионе находятся на S-фазе клеточного цикла (Barnes F.L. et al., 1993). Если используются несинхронизированные бла-стомеры в качестве ядерных доноров, то наблюдается увеличение частоты развития, когда цитоплазма реципиента активирована и активность фактора, стимулирующего мейоз, понижена перед реконструкцией эмбриона (Campbell K.H. et al., 1994). Предварительно активированный ооцит будет принимать Gl (GO), S- или О2-фазы клеточного цикла и определяется термином «Универсальный реципиент» (Campbell K.H. et al., 1993).
Анализ данных различных исследований, в которых были использованы синхронизированные эмбриональные бластомеры в качестве ядер доноров, показывает, что донорские клетки на поздних стадиях G2 или ранней G-1 клеточного цикла являются наиболее пригодными для повышения эффективности развития (Kwen O.Y. et al., 1996).
5.3. ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ
5.3.1. Получение трансгенных животных;;
1.Микроинъекции гена. Получение трансгенных животных путем микроинъекции гена включает извлечение эмбрионов на стадии пронуклеуса хирургическим путем или после убоя доноров. Для получения оплодотворенных яйцеклеток, необходимых для микроинъекции, у животных гормональной обработкой вызывают суперовуляцию по 226
определенной для каждого вида схеме, а затем извлекают яйцеклетки, промывая яйцеводы у наркотизированных или убитых животных (G. Вгет, 1992).
Для микроинъекции эмбрионов необходим стабильный рабочий стол, на который устанавливают инвертированный микроскоп, два микроманипулятора для управления удерживающей и инъекционной пипетками и прибор для регулирования инъекционного давления. На столике микроскопа устанавливают инъекционную камеру со средой, покрытой парафиновым маслом. В среду помещают эмбрионы. Для инъекции эмбрионы по мере надобности посредством пониженного давления фиксируют на удерживающей пипетке так, чтобы инъецируемый пронуклеус был хорошо виден. Кончик инъекционной пипетки (внутренний диаметр около 1 мкм) наполняют раствором ДНК. Для инъекции пипетку через прозрачную оболочку и клеточную мембрану вводят в пронуклеус, после чего в него инъецируют 1—2 пкл раствора ДНК. О точности операции судят по набуханию пронуклеуса. Только такое визуальное увеличение объема ядра свидетельствует о том, что раствор ДНК был действительно введен в пронуклеус. После инъекции эмбрионы освобождаются от удерживающей пипетки и культивируют до момента пересадки реципиентам.
В оплодотворенных яйцеклетках мыши и кролика, извлеченных в соответствии со стадией их развития, пронуклеусы очень хорошо видны и могут быть легко инъецированы. У эмбрионов сельскохозяйственных животных в цитоплазме имеются темные липидсодержащие гранулы, которые затрудняют визуализацию пронуклеусов. В результате центрифугирования при 15000 g в течение 3—5 мин (Wall R.J. et al., 1984) гранулы смещаются к одному полюсу яйцеклетки, а лежащие недалеко от центра пронуклеусы становятся видимыми и доступными для микроинъекций. Для эмбрионов овцы, как правило, не требуется центрифугирования: для визуализации пронуклеусов достаточно применить оптику Номарского с интерференционным контрастом. Несмотря на такую обработку, микроинъекция эмбрионов сельскохозяйственных животных все же сложнее и не может быть выполнена с такой же надежностью и эффективностью, как у мышей и кроликов.
После короткого (до нескольких часов) культивирования in vitro эмбрионы трансплантируют в яйцевод синхронизированных реципиентов. В качестве альтернативы можно использовать длительное культивирование микроинъецированных эмбрионов с последующей пересадкой их в матку синхронизированных реципиентов.
Синхронизация реципиентов и доноров, от которых получают эмбрионы, является необходимым условием для успешного выполнения программ по переносу генов (эмбрионов), так как яичники, яйцеводы и матка должны находиться в соответствующей стадии, чтобы физиологически обеспечить дальнейшее развитие пересаженных эмбрионов. Синхронизация достигается спариванием с вазэктомированными (стериль-
 ными) самцами, индукцией овуляции хорионическим гонадотропином человека (ХГ), «мягкой» суперовуляцией или лютеолизом желтого тела.
ными) самцами, индукцией овуляции хорионическим гонадотропином человека (ХГ), «мягкой» суперовуляцией или лютеолизом желтого тела.
Микроинъецированные яйцеклетки переносят реципиенту хирургической трансплантацией, так как бескровный доступ к яйцеводам даже у крупных сельскохозяйственных животных, кроме коров и кобыл, невозможен. С этой целью реципиентам под наркозом вскрывают брюшную полость, локализуют яичники и яйцеводы, контролируют реакцию яичников на индукцию овуляции (присутствие овуляционных клеток, желтых тел) для исключения непригодных (несинхронизированных) реципиентов. Затем специальный катетер с находящимися в нем микроинъеци-рованными эмбрионами вводят в яйцевод через воронку, после чего в канал яйцевода инъецируют среду с эмбрионами.
Каждому реципиенту мыши, кролика и свиньи пересаживают 20—30 инъецированных зигот, причем у свиней все эмбрионы трансплантируют в один яйцевод, а у мышей и кроликов — раздельно по яйцеводам. У овец, коз и крупного рогатого скота каждому реципиенту пересаживают два-четыре эмбриона.
Животных, родившихся из инъецированных эмбрионов, индивидуально метят, берут у них пробу тканей или крови для доказательства интеграции ДНК. Интеграцию ДНК проверяют PCR-диагностикой, дот-, блотгибридизацией по Саузерну.
Для образования трансгенных линий животных решающее значение в животноводстве имеет получение таких трансгенных животных (трансгенные особи, родившиеся из инъецированных эмбрионов), все или, по крайней мере, часть половых клеток которых содержат трансген. При исследовании родившихся животных и полученного от них потомства было показано, что, несмотря на инъекцию ДНК на ранних стадиях (в пронук-леус оплодотворенных яйцеклеток), могут появляться мозаики. Мозаиками считаются животные, состоящие из двух или нескольких клеточных линий, происходящих из одной зиготы, но имеющих различные генотипы. Трансгенные мозаики кроме клеточных линий, содержащих транс-ген, имеют нетрансгенные линии. При получении от таких животных трансгенного потомства и при выделении трансгенных линий могут возникнуть трудности. Так, если клетки гонад не содержат трансген, потомство не может наследовать инъецированный ген от трансгенной родительской формы. На основании существующих данных можно сделать вывод, что около 30 % первичных трансгенных животных, полученных методом микроинъекции, являются мозаиками (Wilk; T.M. et al., 1986). Поэтому трансген не передается потомству с ожидаемой согласно закону Менделя частотой 50 %. Часть мозаиков вообще не может дать начало трансгенным линиям, так как у них отсутствует передача трансгена по наследству.
В норме наследование трансгена соответствует законам Менделя для моногибридного скрещивания, так как в большинстве случаев интеграция происходит только в одной единственной точке одной хромосомы. 228
По этой причине «гетерозигота» здесь не применима, потому что на гомологичной нетрансгенной хромосоме отсутствует соответствующий трансгену аллель. Что касается мозаиков, то они появляются, как правило, только в Fo-генерации. Животные Fi-генерации и последующих поколений (если они позитивные) содержат генную конструкцию во всех соматических и эмбриональных клетках. Однако в нескольких случаях отмечено нестабильное наследование трансгена через поколение.
Относительно редко в геноме первичных трансгенных животных наблюдается сразу несколько точек интеграции. У трансгенного животного с двумя независимыми участками интеграции можно ожидать, что 75 % потомства будут наследовать трансген (при этом 25 % наследуют один из двух трансгенов и у 25 % в геноме присутствуют обе точки интеграции) и лишь 25 % потомства будут нетрансгенными. При спаривании гомозиготного трансгенного потомства в норме ожидается следующее расщепление: 50 % гомозиготных, 25 % гомозиготных трансгенных и 25 % негативных (нетрансгенных) особей.
Микроинъекция гена в пронуклеус зиготы до 1997 г. оставалась единственным надежным методом получения крупных трансгенных животных. Впервые он применен для получения трансгенных мышей (Gordon J. et al., 1980) и позднее для получения крупных сельскохозяйственных животных (Hammer R.E. et al., 1985). Ввиду ограниченных экономических и технических возможностей этот метод вначале был доступен лишь единичным лабораториям мира для применения его на крупных сельскохозяйственных животных и в частности на крупном рогатом скоте. Проведение микроинъекций генов в оплодотворенные in vitro эмбрионы крупного рогатого скота позволило заменить дорогостоящий прием, основанный на извлечении эмбрионов на стадии пронуклеуса хирургическим путем или после убоя суперовулировавших коров-доноров (Krimpenftort Р., et. al, 1991). Появление нового источника эмбрионов путем оплодотворения in vitro сделало метод микроинъекции генов доступным для большого числа лабораторий, которые не имели возможности содержать коров-доноров. Однако эффективность метода оставалась слишком низкой. Необходимо не менее 100 беременностей после пересадки микроинъеци-рованных эмбрионов, чтобы получить одно трансгенное животное, трансген которого был бы включен в геном животного и оно было способно дать трансгенное потомство.
Эффективность микроинъекций у крупных домашних животных очень низкая (Wai R.J. et al., 1992), а высокая стоимость содержания большого количества животных побудила исследователей искать новые подходы повышения эффективности трансгеноза.
Одним из таких приемов для повышения эффективности микроинъекции является идентификация интеграции гена в эмбрион до пересадки реципиенту. Предполагалось, что присутствие инъецированной ДНК может быть определено у эмбрионов на ранней стадии развития с помощью

 ПЦР (Ninomija Т. et al., 1989). Однако эта техника оказалась неспособной отличить действительно трансгенные эмбрионы в связи с длительным (в течение нескольких дней) сохранением ДНК в неинтеграционной форме.
ПЦР (Ninomija Т. et al., 1989). Однако эта техника оказалась неспособной отличить действительно трансгенные эмбрионы в связи с длительным (в течение нескольких дней) сохранением ДНК в неинтеграционной форме.
Другой подход был основан на определении активности репортерных генов, которые должны были экспрессировать только в том случае, если вся концентрация была интегрирована в геном. Некоторые из них базировались на устойчивости к антибиотикам (Bondioli К., 1996), определении активности люциферазы(МепскМ.С. etal., 1998;NakamuraA. etal., 1998) или зеленого флюорисцирующего белка (GFP). Этот белок легко определить, но, к сожалению, его экспрессия не ограничивается только интегрированной ДНК и поэтому могут быть обнаружены как ошибочная положительная, так и ошибочная отрицательная реакции.
Пересадка трансфицированных ядер открывает возможность пересаживать только трансгенные эмбрионы, так как при этом используются ядра клеток, отобранные на основе трансгенной интеграции. В связи с этим, любой новорожденный организм, полученный после трансплантации этих реконструированных эмбрионов, будет трансгенным и последующая селекция трансгенных эмбрионов не требуется.
Пересадка трансфецированных ядер дает еще другое преимущество, возможность прямой интеграции в специфическую область генома. При микроинъекции трансгены интегрируются в любую часть генома. Это означает, что они могут разрушать весьма существенные гены или размещаться в частях хромосомы, недоступных для транскрипции и трансляции, и, кроме того, они никогда не будут экспрессироваться. С другой стороны, микроинъецированные конструкции могут только обеспечивать дополнительной информацией и тем самым только добавлять информацию к той, которая уже имеется в геноме. Если ставится цель затормозить активность определенного эндогенного гена, то она достигается опосредованной стратегией как антисмысловая РНК или рибозомами. Пересадка ядра может принести пользу от всех других преимуществ «Knock-out» стратегией, которые позволили исключить активность эндогенных генов у мышей. Применение стратегии «Knock-out» еще не осуществлено на крупных животных. Однако решение проблемы получения трансформированных плюропотентных клеточных линий у других видов животных возможно и это лишь вопрос времени.
Ретровирусные векторы.В опытах Chan A.W.S. et al. (1998) трансгенные телята были получены путем введения гена с ретро-вирусным вектором непосредственно в ооцит. Несмотря на то что эта система ограничена размером трансгенов в связи с ограничениями ретрови-русного вектора, она представляет альтернативный метод, по крайней мере, для тех видов, у которых возможно оплодотворение in vitro.
Использование сперматозоидов в качестве векторов экзогенного ДНК до последнего времени остается противоречивой и спорной (Gandolfi. F. et al., 1998). Последние иссле-230
дования показали (Maiore В. et al., 1998), что разноречивые результаты могут быть получены при использовании одинаковой схемы исследований, применяемой в разных лабораториях и даже в одной и той же лаборатории.
Показано, что сперматозоиды являются не единственными зародышевыми клетками самца, которые могут быть использованы в получении трансгенов. В 1994 г. Brinster et al. продемонстрировали, как сперматого-нии могут быть взяты от одного самца и пересажены в семенники самца того же или другого вида и становятся функционирующими. Это дает возможность включения экзогенного гена в эти клетки до пересадки их в семенники другого животного. Трансформация линий зародышевых клеток самца in situ была сообщена рядом исследователей через прямую инъекцию ДНК в семенник живых животных (Kim J.-H. et al., 1997). Это может представлять интерес для видов животных, у которых перенос сперматозоидов в семявыводящие канальцы технически невозможен.
Создание разных типов трансгенных животных.Мечтой многих исследователей-селекционеров мира является разработка возможности не просто отбора животных с измененной хозяйственно-полезной изменчивостью, а преднамеренное изменение генотипа и направленное создание желаемого типа животных. Это оставалось мечтой до тех пор, пока не были сделаны выдающиеся открытия — выявление ДНК как носителя генетической информации, пока не были заложены основы рекомбинант-ной техники (открытие рестракционных энзим, клонирования ДНК и т. д.) или генной инженерии. В относительно короткие сроки были разработаны методы выделения из генома отдельных генов, создания эффективно функционируемых генных конструкций. В последующие годы были разработаны методы введения чужеродных генов в геном животных — реципиентов. Селекционеры получили в распоряжение могучий инструмент для создания животных с совершенно новыми свойствами. Что касается применения переноса генов у сельскохозяйственных животных, то надежды ученых в настоящее время связаны с улучшением продуктивности и качества животноводческой продукции, резистентности к болезням и создания так называемых «генных форм» или трансгенных животных-биореакторов ценных биологически активных веществ.
Трансгенные животные с новыми хозяйственно-полезными свойствами. Одним из основных направлений генной инженерии на первом этапе было изменение наследственности животных в отношении увеличения скорости роста, повышения надоев и улучшение качества продукции.
Рост животного является сложным процессом, который зависит от действия генов, условий питания и факторов окружающей среды. С генетической точки зрения особенно интересны гены, кодирующие протеины каскада гормона роста, а именно, непосредственно гормон роста (ГР), ри-

 лизинг фактора гормона роста (РФ — ГР) и инсулинподобный фактор гормона роста (ИФ ГР).
лизинг фактора гормона роста (РФ — ГР) и инсулинподобный фактор гормона роста (ИФ ГР).
Еще в 40-е годы было установлено стимулирующее действие гипофи-зарного ГР на молочную продуктивность коров. Однако ввиду высокой стоимости препаратов гипофизарного ГР и невозможности его получения из гипофизов животных в больших количествах они не нашли практического применения.
К концу 70-х годов, с началом эры генной инженерии и появлением дешевых гормональных препаратов, полученных путем микробиального синтеза на основе технологии рекомбинантной ДНК, был синтезирован ГР. Было показано, что ГР микробного происхождения оказывает такое же стимулирующее действие на лактацию и рост животного, как и гипо-физарный ГР.
При крупномасштабном применении рекомбинантного ГР (13 мг в день) увеличение удоев составляет 23—31 %. Разработаны формы препарата пролонгированного действия, позволяющие проводить обработку один раз в две недели и даже в месяц.
Ежедневные инъекции ГР молодняку крупного рогатого скота, свиней и овец вызывают увеличение суточных привесов на 20—-30 % и сопровождаются сокращением расхода кормов на единицу прироста. У молодняка свиней ускорение роста сопровождается увеличением содержания белка и уменьшением содержания жира в тканях, что повышает ценность мясопродукции.
Первые трансгенные мыши с геном ГР были получены в 1982 г. У них была установлена повышенная скорость роста (четырехкратная) и удвоенная конечная живая масса.
В противоположность результатам, полученным на мышах, у трансгенных свиней с геном ГРу Пурселя и др. (1988,1989) не наблюдалось соответствующего ускорения роста.
По сообщениям Л.К. Эрнста (1996), у трансгенных свиней с геном ри-лизинг фактора гормона роста (РФ ГР) конечная живая масса была на 15,7 % выше, чем у контрольных животных.
Известно, для ускорения роста свиней при инъекции ГР необходимо скармливать животным корма с повышенным содержанием протеина (18 % сырого протеина) и с дополнительным количеством лизина. У потомства трансгенных свиней, получавших соответствующий модифицированный кормовой рацион, наблюдались на 16,5 % более высокие среднесуточные привесы (Г. Брем и др., 1991).
Трансгенные овцы с геном ГР и РФ ГР имели повышенный уровень ГР, но не обладали повышенной скоростью роста.
Вместе с тем, все авторы единодушно отмечают, что трансгенные свиньи имеют более чем двукратное уменьшение толщины шпика (18—20 мм у контрольных свиней против 7—8 мм у трансгенных). Ана-232
логичным образом трансгенные овцы имели 5—7 % жира по сравнению с 25—30 % у контрольных животных.
Разницу по скорости роста между трансгенными мышами и трансгенными сельскохозяйственными животными некоторые исследователи объясняют следующим образом. В используемых для переноса генов линий мышей не велась селекция по их ростовой продуктивности, тогда как большинство исследуемых свиней происходили из популяций, в которых в течение десятилетий велась селекция по этому показателю. Подтверждением этого предположения является тот факт, что селекция мышей в течение 30 поколений по скорости роста сопровождалась удвоением у них живой массы. Они имели лишь незначительно меньшую конечную живую массу по сравнению с трансгенными мышами. Отсюда можно сделать вывод, что введение чужеродного гена ГР в популяцию линий мышей, не подвергнутых селекции на скорость роста, вызывает скачок на более высокое ростовое плато. В имеющихся популяциях свиней, наоборот, генетический потенциал роста, по-видимому, находится недалеко от потенциального плато и поэтому дополнительным введением гормона роста или переносом генов гормона роста можно добиться лишь сравнительно незначительного эффекта в скорости роста.
Более реальные перспективы улучшения качества или состава продуктов животноводства достигают введением соответствующих генных конструкций в организм животного. Рассматривается, например, возможность уменьшения лактозы в молоке путем создания трансгенных овец или крупного рогатого скота, которые несут специфический для молочной железы промотор, сцепленный с геном лактозы. При этом становится возможным расщепление лактозы (молочного сахара) на глюкозу в галактозу уже в молоке коров. Молоко таких животных может использоваться людьми, у которых отсутствует фермент лактозы.
Обсуждается также возможность введения генов, вырабатывающих определенные антитела, которые предотвращают маститы.
Все исследователи отмечают увеличение содержания белка и уменьшение содержания жира в тканях трансгенных животных с генами гормона роста, что заметно повышает качество и товарную ценность получаемых мясопродуктов. По сообщению В.Г. Пурселя и др. (1989), толщина шпика у трансгенных линий свиней на спине в области 10-го ребра составила 7,4 ± 2,3 мм по сравнению с толщиной шпика у контрольных животных (сибсов) 21 ± 1,7 мм. По данным Л.К. Эрнста (1996), содержание жира в туше трансгенных свиней было на 10,5—13,1 % ниже, чем у контрольных.
Эти исследования дают основание предполагать, что молекулярные
методы повышения продуктивности и особенно улучшения качества про
дукции будут играть важную роль в зоотехнической науке и в развитии
животноводства в целом. w.-- *


 Трансгенные животные с устойчивостью к заболеваниям. Потери, вызванные заболеваемостью у сельскохозяйственных животных, составляют более 10% стоимости продукции. Поэтому все более важное значение приобретает селекция животных по резистентности к заболеваниям. Резистентность — это наследственная генетически обусловленная восприимчивость животных к определенным микроорганизмам, вирусам, паразитам или токсинам.
Трансгенные животные с устойчивостью к заболеваниям. Потери, вызванные заболеваемостью у сельскохозяйственных животных, составляют более 10% стоимости продукции. Поэтому все более важное значение приобретает селекция животных по резистентности к заболеваниям. Резистентность — это наследственная генетически обусловленная восприимчивость животных к определенным микроорганизмам, вирусам, паразитам или токсинам.
К сожалению, попытки вести селекцию на устойчивость к разным заболеваниям не дали радикальных результатов, хотя известны отдельные положительные примеры. Созданы, в частности, популяции крупного рогатого скота с примесью крови зебу, которые устойчивы к ряду кровепа-разиторных заболеваний. Резистентность к ряду заболеваний является полигенным признаком, как, например, трипанотолерантность определенных африканских пород крупного рогатого скота, которые, кроме резистентности к заболеваниям, отличаются хорошей жаровыносливостью и нетребовательностью к условиям содержания и кормления. Вместе с тем, имеются механизмы резистентности, которые основываются на единичных генах, как, например, резистентность к диарее у новорожденных поросят, обусловленная Е. coli K88, или резистентность к гриппу у мышей.
Это послужило основанием для получения трансгенных животных с чужеродными генами, которые, возможно, обеспечат невосприимчивость таких животных к отдельным заболеваниям.
Защитные механизмы от инфекционных заболеваний функционируют путем препятствия вторжению возбудителя, или путем изменения рецепторов. Вторжению или размножению возбудителей препятствуют, главным образом, иммунные механизмы и экспрессия генов главного комплекса гистосовместимости, а также иммунологические способности различных молекул, таких, как интерферон, нейропептиды, гормоны и интерлейкины.
Одним из примеров гена резистентности является ген Мх мыши. Этот ген, найденный в модифицированной форме у всех видов млекопитающих, вырабатывает у Мх+-мышей иммунитет к вирусу гриппа А. Этот ген был выделен, клонирован и использован, в частности, для получения трансгенных свиней, которые экспрессировали ген Мх на уровне РНК (Г. Брем и др., 1991). Однако пока не получено данных об экспрессии у трансгенных свиней Мх-протеина и доказательства резистентности трансгенных свиней к вирусу гриппа.
В Голландии исследуется возможность получения трансгенных животных, способных повысить содержание лактоферина в тканях молочной железы с целью повышения резистентности к маститу.
Большой интерес представляют исследования по получению трансгенных животных с генами антисмысловой (ас) РНК. Экспрессия анти-смысловой РНК в клетках приводит к последующей гибридизации со 234
смысловой РНК и, следовательно, к ингибированию репликации виру-сального генома.
Т.И. Тихоненко была создана конструкция гена антисмысловой РНК против аденовируса и в Биотехцентре (М.И. Прокофьев) получены трансгенные кролики. На культуре клеток из почек этих животных было показано, что клеточные линии, содержащие трансгенную антисмысловую РНК, имели на 90—98 % более высокую резистентность против Ads по сравнению с контрольными линиями клеток.
В других экспериментах этой же группы ученых продемонстрирована устойчивость трансгенных животных с геном антисмысловой РНК против лейкоза крупного рогатого скота к заражению вирусом лейкоза. У трансгенных кроликов с геном антисмысловой РНК против лейкоза крупного рогатого скота, зараженных антигеном р24, уровень антител был значительно ниже и не превышал титр 1 : 500 по сравнению с контрольными, у которых он изменялся в пределах 1 : 6000 — 1 : 8000.
Показана возможность создания внутриклеточной иммунизации против инфекционных вирусов. Эндогенные вирусные белки, в особенности их мутационные формы, могут служить защитой от соответствующих вирусов. В частности, получены трансгенные куры, устойчивые к вирусу лейкоза, у которых в клетках экспрессировался белок вирусной оболочки.
Приведенные выше данные открывают реальные перспективы повышения резистентности трансгенных животных к заболеваниям.
Применение техники трансгеноза для у л у ч -шения состава молока. Одним из наиболее эффективных путей расширения рынка и кардинального снижения стоимости производства молочных продуктов может быть улучшение состава молока путем получения трансгенных животных. В результате генетической селекции в последние десятилетия молочная промышленность достигла значительного улучшения качества молочной продукции. Однако новые генетические успехи, основанные на традиционных методах селекции, слишком медленны вследствие длительного интервала между поколениями. Это ограничивается также низкой наследуемостью этих качеств, взаимоотношениями между ними и потому, что различные молочные продукты могут быть получены от селекции в различных направлениях.
Большинство из наиболее важных изменений в составе молока были инициированы фармацевтической промышленностью. Коммерческий рынок для биореакторов, оцененный в размере 3 млрд. долларов в год, в США привлек интерес фармацевтической промышленности. Они вскоре реализовали потенциальную возможность синтеза и секреции молочной железы и несколько фармацевтических продуктов были синтезированы в молоке. Эффективность молочной железы в качестве биореактора настолько высока, что стоимость продукции может быть многократно снижена даже если процесс очистки еще недостаточно эффективный.


 Однако не только фармацевтические белки могут быть эффективно произведены в молочной железе. Биологически активные пептиды могут быть также получены с достаточно высокой эффективностью. Недавно у трансгенных кроликов был получен с молоком кальцитонин-пептид, ответственный за регуляцию обмена кальция и используемый при остеопо-розе (Мс Кее С. et al., 1998). Важным непрямым эффектом биофарминта, который ожидается в ближайшем будущем, могут быть изменения в области получения трансгенных продуктов с молоком, которые бы могли стать источником заботы о человеческом здоровье.
Однако не только фармацевтические белки могут быть эффективно произведены в молочной железе. Биологически активные пептиды могут быть также получены с достаточно высокой эффективностью. Недавно у трансгенных кроликов был получен с молоком кальцитонин-пептид, ответственный за регуляцию обмена кальция и используемый при остеопо-розе (Мс Кее С. et al., 1998). Важным непрямым эффектом биофарминта, который ожидается в ближайшем будущем, могут быть изменения в области получения трансгенных продуктов с молоком, которые бы могли стать источником заботы о человеческом здоровье.
Традиционно стоимость молока оценивалась по содержанию жира, но эта концепция меняется и отдается предпочтение другим компонентам молока, как протеин.
Ценные изменения в составе молока могут быть достигнуты количественно, путем изменения соотношения компонентов молока, или качественно, т. е. путем добавления других компонентов, не присутствующих в составе натурального молока, которые усилят его питательную ценность. В молоке четыре основных компонента: жир, белок, лактоза и транспортный компонент. Несколько экспериментов с трансгенными мышами показали, что возможно получить молоко, которое более соответствует существующему промышленному процессу и требованиям потребителя и получить это можно в уже в первом поколении.
Качественные изменения в составе молока, достигаемые с помощью трансгенных живот-н ы х. Изменения в составе белка молока. С экономической точки зрения представляет интерес увеличение содержания казеина в молоке, в связи с его влиянием на производство сыра. Казеиновые мицеллы вовлекают жир и воду во время формирования сыра, играя, таким образом, важную роль в уменьшении к-казеина в молоке трансгенных мышей (Gutierrez — Adan A. et al., 1996), сопровождаясь значительным увеличением силы створаживания молока и уменьшением диаметра мицелл. Уменьшение диаметра мицелл должно привести к увеличению их поверхности, что в свою очередь способствует образованию более плотного творожного сгустка, скорости его формирования и увеличению выхода сыра. Эти измененные свойства молока представляют большую пользу и интерес для молочной промышленности.
Считается, что молочная железа имеет ограничения в способности синтеза белка. Любое дополнительное производство белка компенсируется уменьшением количества эндогенных белков молока. Основываясь на этом, имеется другой возможный путь увеличения уровня казеинов, а именно, торможение производства других белков, представляющих меньший интерес. Для этой роли подходит Р-лактоглобулин. Этот белок присутствует только в молоке жвачных и является основным аллергеном молока коров. Поэтому уменьшение его количества могло бы улучшить состав молока. В целях уменьшения или торможения активности 236
определенного гена были использованы антисенсы к РНК или рибосомы (Sokol D.L. et ai., 1996).
Уменьшение уровня лактозы в молоке. Лактоза является основным сахаром в молоке и ответственна за нарушения пищеварения у большого процента популяции взрослых, когда уменьшаются уровни фермента лактазы во время отъема. Этот фермент гидролизует лактозу на моносахариды. Несколько промышленных приемов были направлены на получение молока с уменьшенным содержанием лактозы в молоке после доения. Это было бы полезно не только для человека, но и в молочной промышленности. Оно способствовало бы увеличению эффективности производства сыра (Hettinga D.H, 1989).
Трансгенная технология пытается решить эту задачу несколькими путями. Во-первых, некоторые эксперименты основывались на производстве молока с низким содержанием лактозы. С этой целью а-лактальбу-мин-дефицитные мыши были получены через гомологенную рекомбинацию (Stinnakre M.G. et al., 1994), так как этот белок является одним из компонентов комплекса синтеза лактозы. Вследствие этой генетической манипуляции мыши производили молоко с низким содержанием или с отсутствием лактозы. Однако этот сахар играет роль в регуляции осмотического давления молочной железы и поэтому проявлялся отрицательно — мало молока с высокой вязкостью и лактирующие животные были не способны прокормить потомство.
Другой подход уменьшения концентрации лактозы в молоке основан на вызывании ее гидролиза in vivo подобно тому, как это достигается в молочной промышленности in vitro, чтобы адаптировать молоко нетолерантным человеческим потребителям. Лактоза гидролизуется путем экспрессии лактозы в тканях молочной железы. При этом одним приемом решаются две проблемы, а именно, не нарушается продукция молока, так как осмотическая активность лактозы сохраняется, а концентрация этого сахара значительно уменьшается в молоке, не оказывая побочного влияния на молочные соски (Jost В. et al., 1999).
Качественные изменения в составе молока. Молоко наряду с присущей ему ценностью может быть использовано в качестве транспортного средства для других веществ, которые усиливают не только его питательные, но также и функциональные свойства. Например, проявляется лак-тоферрин, кислый белок человеческого молока с бактериостатическими свойствами, который усиливает адсорбцию железа. Этот белок присутствует на очень низком уровне в молоке коров и увеличением его концентрации могут быть достигнуты несколько целей. Например, получены трансгенные мыши, экспрессирующие человеческий лактоферрин (Platenburg G.J. et al., 1994). В этих опытах показано, что лактоферрин увеличивает адсорбцию железа и защищает сохранность потомства, так
 как ограничивает наличие свободного железа в межклеточном пространстве тракта, контролируя, тем самым, размножение бактерий.
как ограничивает наличие свободного железа в межклеточном пространстве тракта, контролируя, тем самым, размножение бактерий.
Этот подход позволяет получать гуманизированное молоко, легче переводить его в молоко для новорожденных. С учетом этого получен трансгенный бык, несущий человеческий ген лактоферрина (Krimpenfort P. et al., 1991).
Бактериостатическое влияние может быть также достигнуто другими белками, направленными непосредственно в молочную железу и вызывающими уменьшение заболевания маститами. Например, лизоцим (Maga E.A. et al., 1995) оказывает не только антибактериальное влияние, но также способствует увеличению выхода сыра, вследствие его связи с казеинами. Возможно, он также вызывает специфический пассивный иммунитет у новорожденных с секрецией специфических антител. Высокие титры нейтрализующих антител были получены в молоке трансгенных мышей против специфических вирусных агентов, вызывая экспрессию специфических иммуноглобулинов в молочную железу (Castilla J. et al., 1998).
Таким образом, в результате секреции человеческих белков в молоко коров возможно его гуманизировать и сделать более адекватным для потребления человеком. Включения человеческого лактоферрина, человеческого лизоцима или человеческих иммуноглобулинов являются примером такой гуманизации молока коров. Но эти включения имеют дополнительную терапевтическую пользу. Можно также заменить животный белок его человеческим аналогом, не оказывая влияния на физиологическую активность животного.
Трансгенные животные, продуцирующие биологически активные вещества медицинского и технологического назначения. Основа стратегии использования трансгенных животных как биореакторов состоит во включении в клетки организма генов, которые вызывают у них синтез новых белков, как правило, медицинского и технологического назначения.
Раньше такие белки были выделены из тканей и биологической жидкости тканей человека, таких как кровь (фактор свертываемости крови и другие белки крови) и гипофиз (гормон роста). Вследствие дороговизны и трудности получения человеческих тканей эти белки могут производиться в малых количествах и к тому же являются объектом контаминации патогенных организмов, таких как вирус гепатита и др.
На первом этапе практического применения молекулярной генетики были
Дата добавления: 2015-07-14; просмотров: 4984;
