Будова та класифікація білків
Елементарний аналіз різних білків свідчить, що складовими елементами всіх білків є наступні п’ять:
| C — 50…55% H — 6,6…7,3% O — 21,5…23,5% | N — 15…17% S — 0,2…2,5% |
Через присутність різноманітних функціональних груп білки не можна віднести до якогось певного класу органічних сполук. За хімічним складом білки поділяють на дві групи — прості та складні. За фізіологічними функціями — фібрилярні та глобулярні білки. Із фібрилярних блків побудовані волокна живих тканин. До них відносяться кератин (шкіра, волосся, нігті, роги, пір’я, м’язи). Глобулярні білки підтримують і регулюють життєві процеси. До них належать усі ферменти, гемоглобін — носій кисню у крові, багато гормонів, зокрема інсулін підшлункової залози.
Білки мають тривіальні назви, наприклад, гемоглобін, рибонуклеаза, фібриноген та інші.
Будова молекул. Складність виділення. Гіпотеза О.Я. Данилевського (1888 р.) — амінокислоти в білках зв’язані амідним зв’язком 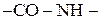 , який отримав назву пептидного зв’язку. Трохи пізніше Гофмейстер і Е. Фішер експериментально підтвердили цю гіпотезу. Перший білок, будова якого була розшифрована – гормон інсулін (Фромажо і Сейнгер) –
, який отримав назву пептидного зв’язку. Трохи пізніше Гофмейстер і Е. Фішер експериментально підтвердили цю гіпотезу. Перший білок, будова якого була розшифрована – гормон інсулін (Фромажо і Сейнгер) – 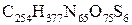 . Було встановлено, що молекула інсуліну складається з двох поліпептидних ланцюгів, які зв’язані дисульфідними містками. Усього в інсуліні 51
. Було встановлено, що молекула інсуліну складається з двох поліпептидних ланцюгів, які зв’язані дисульфідними містками. Усього в інсуліні 51  -амінокислота, поліпептидні ланцюги складаються з 21 і 30
-амінокислота, поліпептидні ланцюги складаються з 21 і 30  -амінокислот.
-амінокислот.
Кожна білкова молекула має певну будову, яка визначається послідовністю розташування амінокислот у поліпептидних ланцюгах, характерним розміщенням цих ланцюгів у просторі, здатністю створювати молекулярні структури у вигляді глобул або фібрил. Для зручності вивчення будови молекул білка, їх розташування в просторі визначають різні рівні структури білкової молекули: первинну, вторинну, третинну і четвертинну.
Первинна структура — це певна послідовність амінокислот у молекулах білків, сполучених між собою ковалентними пептидними зв'язками. Первинна структура стабілізується також дисульфідними зв'язками, якщо вони є в білковій молекулі.
Вторинна структура кожної білкової молекули характеризується просторовим розміщенням поліпептидного ланцюга (конформацією молекули). Вторинна структура обумовлена утворенням водневих зв’язків між полярними пептидними групами 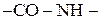 .
.
На основі рентгеноструктурних досліджень поліпептидів і білків Л. Полінг і Р. Корі встановили, що в складі природних глобулярних білків поліпептидні ланцюги можуть утворювати 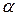 -спіраль, в якій на один виток припадає 3,6 залишку амінокислоти. Крок спіралі — відстань між витками — дорівнює 0,54 нм, кут підйому витка — 26°, висота одного залишку амінокислоти становить 0,15 нм. Радикали залишків амінокислот знаходяться на поверхні спіралі.
-спіраль, в якій на один виток припадає 3,6 залишку амінокислоти. Крок спіралі — відстань між витками — дорівнює 0,54 нм, кут підйому витка — 26°, висота одного залишку амінокислоти становить 0,15 нм. Радикали залишків амінокислот знаходяться на поверхні спіралі.
Ступінь спіралізації поліпептидних ланцюгів білка залежить від його первинної структури. Так, молекули гемоглобіну і міоглобіну спіралізовані на 75 %, альбуміну сироватки крові — на 50 %, пепсину — на 28 %.
Крім 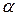 -спіралі поліпептидний ланцюг може формувати іншу впорядковану конформацію, яка дістала назву β-структури, або складчастого шару. β -Структура утворюється поліпептидними ланцюгами, які розміщені паралельно і сполучаються між собою за рахунок водневих зв'язків між поліпептидними групами, розміщеними поруч.
-спіралі поліпептидний ланцюг може формувати іншу впорядковану конформацію, яка дістала назву β-структури, або складчастого шару. β -Структура утворюється поліпептидними ланцюгами, які розміщені паралельно і сполучаються між собою за рахунок водневих зв'язків між поліпептидними групами, розміщеними поруч.
β-Структура найбільш поширена в білках опорних тканин — колагені (білок сполучної тканини, сухожилля, шкіри), фіброїні (білок шовку), кератині (білок волосся). У багатьох білках одночасно зустрічаються ділянки 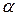 -спіралі і β-структури.
-спіралі і β-структури.
Третинна структура характеризується розташуванням у просторі спіралізованих поліпептидних ланцюгів з утворенням глобулярних або фібрилярних білкових молекул. Утворення третинної структури обумовлено взаємодією функціональних груп радикалів амінокислот.
Четвертинна структура білка — це просторове розміщення кількох білкових поліпептидних ланцюгів, кожний з яких має певні первинну, вторинну і третинну структури.
Дата добавления: 2015-08-14; просмотров: 2096;
