Синтез коллагена
На примере коллагена -I: характерен для кости, является основным белком дентина. (закрепляем материал по посттрансляционному процессингу белка и ферментам микросомального окисления)
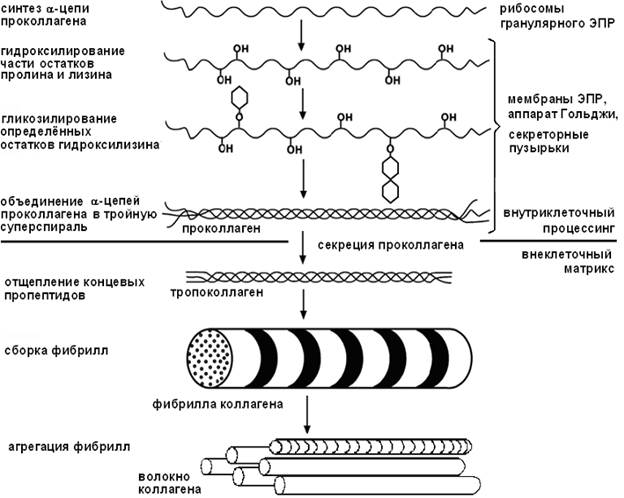
Коллаген синтезируется в фибробластах в виде высокомолекулярного предшественника – проколлагена.
На этапах синтеза коллагена после включения пролина и лизина в полипептидную цепь происходит их гидроксилирование (специфично для молекулы коллагена). Образование гидроксипролила и гидроксилизила катализируют железосодержащие ферменты — пролилгидроксилаза и лизилгидроксилаза, их кофактор — аскорбиновая кислота. Гидроксилирование аминокислот является диоксигеназной реакцией, т.е. молекула кислорода одновременно окисляет два субстрата (аминокислоту и a-кетоглутарат):
 |
В результате реакции образуются оксипролин и сукцинат (в молекулу которого включён второй атом кислорода из молекулы О2) и выделяется СО2. Реакция высокоспецифична – остатки пролина и лизина подвергаются гидроксилированию, если они расположены со стороны аминогруппы глицинового остатка. Аскорбиновая кислота работает как восстановительный агент, благодаря которому железо в активном центре фермента сохраняется в форме Fe2+. При недостатке витамина С синтез коллагена нарушается, возникает непрочность коллагеновых волокон, кровоточивость десен, расшатывание зубов (проявления цинги). Расшатывание зубов обусловлено, главным образом, недогидроксилированием вновь синтезированного коллагена периодонтальной связки. Такой коллаген плохо агрегирует.
К остаткам гидроксилизина под действием сначала галактозилтрансферазы, затем глюкозилтрансферазы присоединяются углеводные единицы (сначала – одна галактоза, затем некоторые галактозы достраиваются до дисахарида – галактоза-глюкоза).
Гидроксилирование и трансферазная реакция происходят во вновь синтезированном коллагене, ещё не претерпевшем спирализации в просвете эндоплазматического ретикулюма. Затем каждая про-a-цепь с помощью водородных связей объединяется с двумя другими в молекулу проколлагена, которая секретируется в межклеточный матрикс.
• Проколлаген имеет более длинные цепи, чем тропоколлаген. Дополнительные концевые фрагменты не образуют обычную трехцепочечную спираль, а объединяются друг с другом в глобулярные домены, структура которых совершенно не похожа на уникальную линейную структуру зрелого коллагена (например, есть дисульфидные мостики). Это препятствует агрегации и образованию фибрилл внутриклеточно, что было бы фатальным для клетки. Вне клетки протеолитические ферменты последовательно удаляют оба домена – N-концевой и С-концевой (маркёры синтеза коллагена).
Ниже Более подробная схема синтеза коллагена
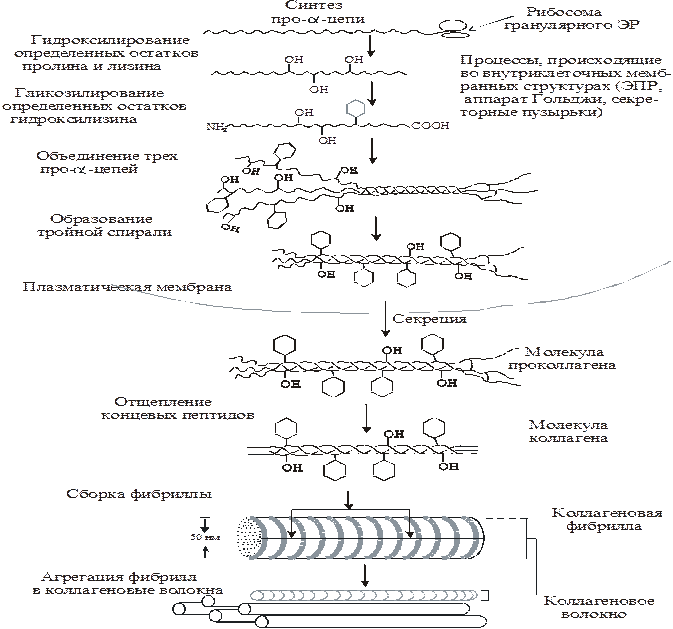
После того как во внеклеточном пространстве сформировались коллагеновые фибрилы, их прочность существенно увеличивается, так как образуются ковалентные сшивки между остатками лизина внутри и между молекулами тропоколлагена,укрепляя четвертичную структуру.
Сшивки создаются в несколько этапов.
I этап. Вначале некоторые остатки лизина и гидроксилизина дезаминируются лизилоксидазой с образованием альдегидных групп, обладающих высокой реакционной способностью. Затем эти группы самопроизвольно реагируют с образованием ковалентных связей друг с другом или с другими остатками лизина или гидроксилизина.
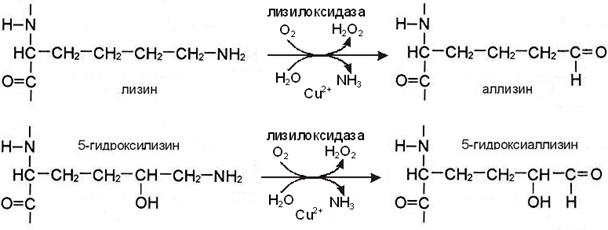
II этап. Альдегидные группы самопроизвольно взаимодействуют друг с другом, образуя альдольные поперечные связи коллагена, или реагируют с аминогруппой остатков лизина или 5-гидроксилизина (рис. А), обеспечивая образование бифункциональных ковалентных сшивок между соседними молекулами тропоколлагена.
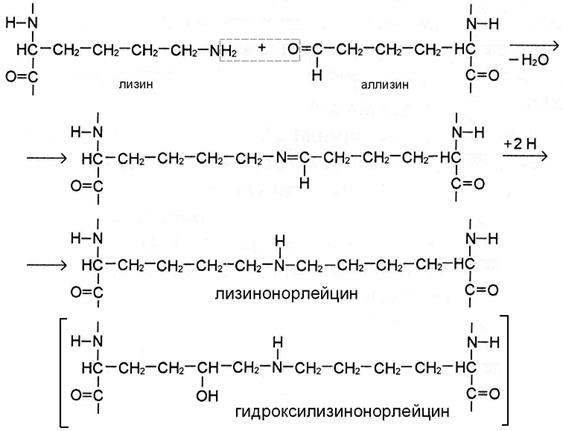 РИС А
РИС А
Если в реакции участвует аллизин, то она протекает по механизму альдиминной конденсации. При этом по иминной связи промежуточного соединения присоединяются 2 атома Н. В результате образуются сшивки с группировкой -NH- в середине – лизиннорлейцин или гидроксилизиннорлейцин (рис. А).
Присутствие гидроксильной группы в 5 положении гидроксиаллизина предопределяет течение реакции по механизму кетоиминной конденсации (рис Б). В этом случае в цепи получившейся поперечной сшивки лизино-5-кетонорлейцина или гидроксилизино-5-кетонорлейцина вместе с группировкой -NH- присутствует кето-группа.
Цепочки таких перемычек достаточно длинные, чтобы иметь некоторую гибкость, а ковалентное соединение атомов придаёт им высокую прочность и закрепляет регулярную структуру микрофибрилл коллагена.
Поперечные бифункциональные сшивки имеют свой вариант упорядоченности: каждый концевой телопептид тропоколлагена соединён перемычкой с расположенным на том же уровне участком смежной молекулы (рис. 9). Подобная локализация и прочность сшивок позволяет обнаружить их в составе N- и C-телопептидов, отщепляемых при распаде коллагена (для идентификации таких специфичных фрагментов разработаны методы, основанные на иммуноферментном анализе).
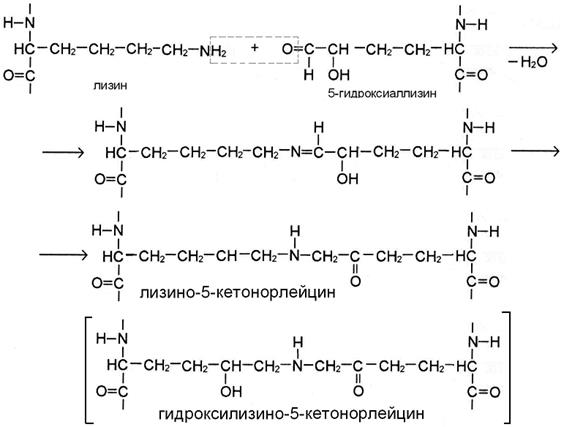 РИС Б
РИС Б
Бифункциональные связки наиболее присущи фибриллообразующим коллагенам типа I, II и III, причём в зависимости от вида ткани преобладает какой-либо определённый вид сшивки.
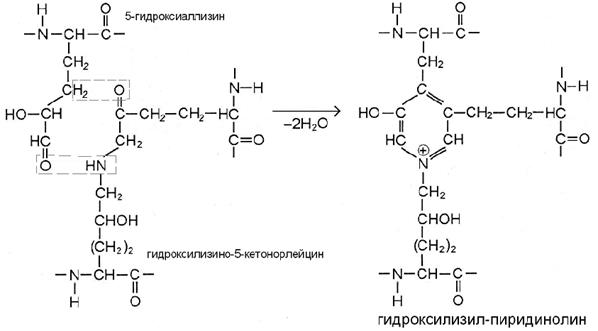
III этап. По мере созревания ткани возникают перемычки и между микрофибриллами. В бифункциональных сшивках сохраняются реакционноспособные атомы, которые постепенно вступают в реакции дополнительной конденсации с образованием трифункциональных сшивок, имеющих в центре гетероцикл – пиридиниевое или пиррольное кольцо (рис. В, Г). Эти процессы протекают также неферментативно путём спонтанного взаимодействия кетоиминной двойной сшивки одной микрофибриллы с альдегидным радикалом, расположенным в телопептидной части другой микрофибриллы.
Если в реакции участвуют 5-гидроксиаллизин и уже сформированная сшивка гидроксилизино-5-кетонорлейцина, то продукт – гидроксилизил-пиридинолин (рис. В).
В большинстве тканей это главная трифункциональная сшивка коллагенов.
В минерализуемых тканях (кость, ткани зуба) число пиридиниевых сшивок в 5-10 раз меньше, чем в хряще и сухожилиях, причём чаще всего здесь встречается лизил-пиридинолин – вариант с негидроксилированной цепочкой в перемычке, образованной с участием лизино-5-кетонорлейцина. Более того, для минерализованных тканей характерны сшивки пиррольного типа, которые образует негидроксилированный аллизин, соединяясь с бифункциональной сшивкой гидроксилизино-5-кетонорлейцином (рис. Г). Из всех трифункциональных перемычек для минерализуемых тканей специфичен именно гидроксилизилпиррол. Дополнительные перемычки циклического характера нужны для повышения механической прочности волокон коллагена.
 В
В
Г
Остатки лизина и 5-гидроксилизина подвергаются окислению постепенно, поэтому количество поперечных связей между отдельными молекулами тропоколлагена, соседними микрофибриллами и пучками волокон с течением времени увеличивается, прочность коллагена возрастает: идёт процесс «созревания».
Учитывая роль ЛИЗ в организации различных вариантов ковалентных сшивок в коллагеновой матрице костной ткани, зубного дентина и цемента становится понятной материальная основа применения лизина как средства, предотвращающего заболевания зубов.
Дата добавления: 2015-08-14; просмотров: 6804;
