Уравнение состояния идеальных газов
Как выше указывалось, основные параметры состояния (абсолютное давление, удельный объем и абсолютная температура) однородного тела зависят один от другого и взаимно связаны математическим уравнением вида
f (р,V,Т) = 0, которое называют уравнением состояния.
Это уравнение справедливо как для реальных, так и идеальных газов. Однако ввиду больших принципиальных трудностей до сих пор не удалось создать универсальное уравнение для реальных газов, которое охватывало бы все области изменения их состояний. Наиболее простое уравнение состояния может быть получено для идеального газа.
Из молекулярно-кинетической теории следует, что абсолютное давление газа численно равно 2/3 средней кинетической энергии поступательного движения молекул, заключенных в единице объема:
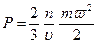
где n — число молекул в объеме V, υ — объем 1 кг газа; m — масса молекулы; ω — средняя квадратичная скорость поступательного движения молекул; 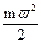 - средняя кинетическая энергия молекулы.
- средняя кинетическая энергия молекулы.
Молекулярно-кинетическая теория газов устанавливает прямую пропорциональность между средней кинетической энергией молекулы и абсолютной температурой
Дата добавления: 2015-08-14; просмотров: 1043;
